实验六 电解质溶液和缓冲溶液
一、实验目的
1.熟悉强电解质和弱电解质的区别。
2.掌握酸碱指示剂及pH试纸测定溶液酸碱度的方法。
3.了解离子反应发生的条件。
4.熟悉不同类型盐类水溶液的酸碱性。
5.熟悉缓冲溶液的配制方法。
二、实验原理
1.强电解质和弱电解质
强电解质在水溶液中完全电离,以离子形式存在;弱电解质在水溶液中部分电离,以离子和分子形式存在。
2.离子反应发生的条件
生成沉淀、气体和难电离的物质,具备三个条件之一即能发生离子反应。
3.盐类水解
在溶液中,强碱弱酸盐、强酸弱碱盐或弱酸弱碱盐电离出来的离子与水电离出来的H+或OH-生成弱电解质的过程叫做盐类水解。
4.缓冲溶液
缓冲溶液是指不因稀释或加入少量强酸或强碱而使其pH值有明显改变的溶液。缓冲溶液可以由弱酸及其共轭碱或弱碱及其共轭酸组成。
缓冲溶液的pH值计算公式:pH=pKa+lg[B-]/[HB]
根据公式,可配制一定pH值的缓冲溶液,也可以计算一定浓度和体积的共轭酸及其共轭碱配成的缓冲溶液的pH值。
由于缓冲溶液中有抗酸抗碱成分,故加入少量的强酸、强碱,其pH值几乎不变,但所有缓冲溶液的缓冲能力都有一定的限度,即各具有一定的缓冲容量,如果加入强酸或强碱的量超过了缓冲溶液的缓冲能力,则缓冲溶液将失去缓冲作用。
三、仪器和药品
1.仪器:试管、试管架、移液管(5ml、10ml)、玻璃棒、点滴板。
2.药品:1mol/L HCl、1mol/L HAc、1mol/L NaOH、1mol/L NaAc、1mol/L NaCl、0.5mol/L AgNO3、3mol/L H2SO4、3mol/L Na2SO4、0.1mol/L BaCl2、0.1mol/L Na2CO3、1mol/L NH3·H2O、1mol/L FeCl3、大理石、广泛pH试纸、红、蓝石蕊试纸。
四、实验内容
1.强电解质和弱电解质
取2支试管,分别加入1mol/L HCl和1mol/L HAc各1ml,然后各加入大小相同的大理石,观察并记录现象,解释原因。
用干净的玻璃棒分别蘸取1mol/L HCl和1mol/L HAc,滴在pH试纸上,测定并记录溶液的pH值。解释原因。
2.离子反应
(1)取2支试管,分别加入1mol/L NaCl和1mol/L HCl各2ml,再加入0.5mol/L AgNO3数滴,观察并记录现象,解释原因,写出离子反应方程式。
(2)取2支试管,分别加入3mol/L H2SO4和3mol/L Na2SO4各2ml,再分别加入0.1mol/L BaCl22滴,观察并记录现象,解释原因,写出离子反应方程式。
(3)在1支试管中加入0.1mol/L Na2CO32ml,滴加1mol/L HCl数滴(不要振荡),观察并记录现象,解释原因,写出离子反应方程式。
3.盐类水解
在白色点滴板的凹穴内,分别放入红、蓝石蕊试纸和pH试纸各3条,然后分别滴入1mol/L NaCl、1mol/L Na2CO3、1mol/L FeCl3各1滴,用pH试纸测定溶液pH值,用红、蓝石蕊试纸测定溶液酸碱性,观察并记录现象,解释原因,将结果填入表6-1。
表6-1 盐类酸碱性

4.缓冲溶液的配制和性质
(1)HAc-NaAc缓冲溶液的配制:依据表6-2中数据配制不同浓度比的缓冲溶液。
表6-2 HAc-NaAc缓冲溶液pH值
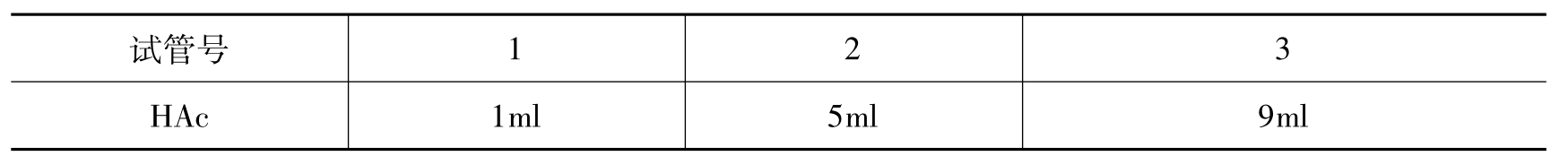
续表6-2

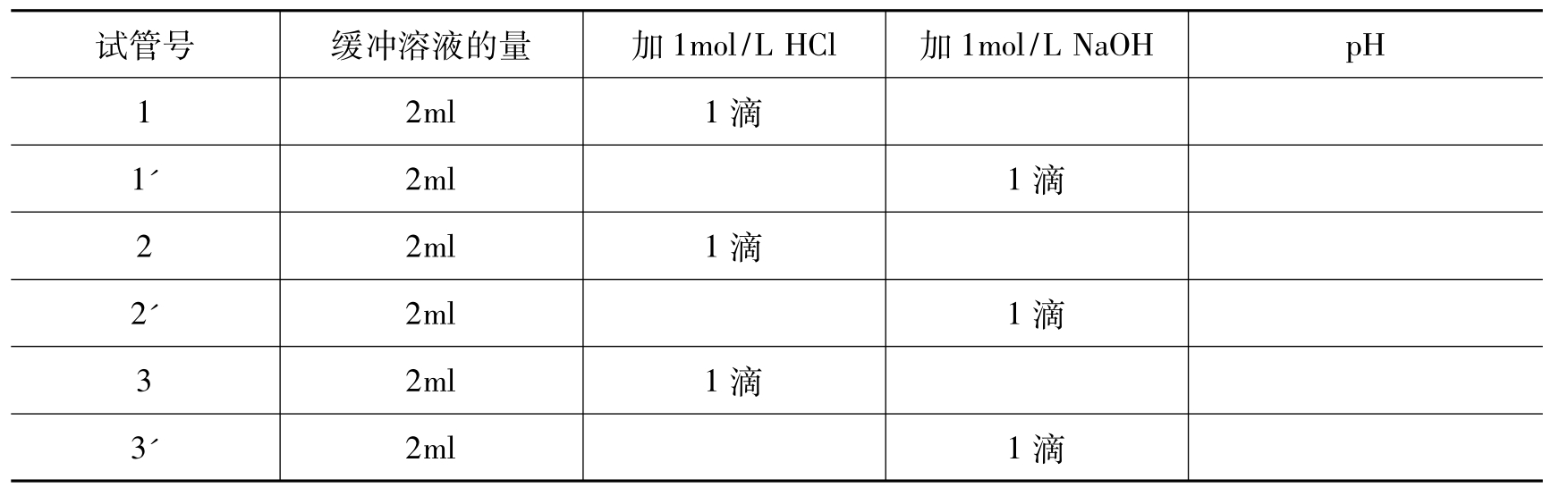
(2)缓冲溶液的抗酸抗碱作用:依据下表做实验,将上述1号试管的缓冲溶液平均分装在1号,1'号两支试管,同样2号和3号试管中的缓冲溶液平均分装在2号,2'号和3号,3'号试管,用pH试纸测定溶液的pH,记录数据(表6-3),解释原因。
表6-3 缓冲溶液的抗酸抗碱作用
五、实验讨论
1.通过实验,归纳缓冲溶液有哪些性质?
2.缓冲溶液的pH值由哪些因素决定?
[注意事项]
1.缓冲溶液的配制要注意精确度。
2.了解pH计的正确使用方法,注意电极的保护。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














