蛋白质的液滴形态
胖头鱼鱼头
1.细胞内的液体结构(separated liquid phase)及其在神经疾病中的可能意义。
一句话摘要:细胞内有些蛋白质可以在液滴(油滴)、凝胶(果冻)和纤维沉淀(海胆……)三种形态之间转换,这一过程的病变有可能导致可怕的神经疾病。
一点背景
细胞是这样的:
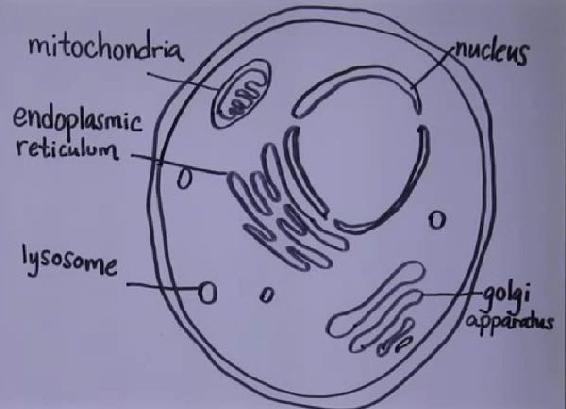
里面充满了各式各样的小作坊:细胞核,线粒体,内质网,高尔基体,溶酶体,等等。
这些作坊都具有膜质结构,也就是用一层或两层油脂的膜把膜内的环境和细胞质分离开来。
但细胞里还有些其他的小作坊:
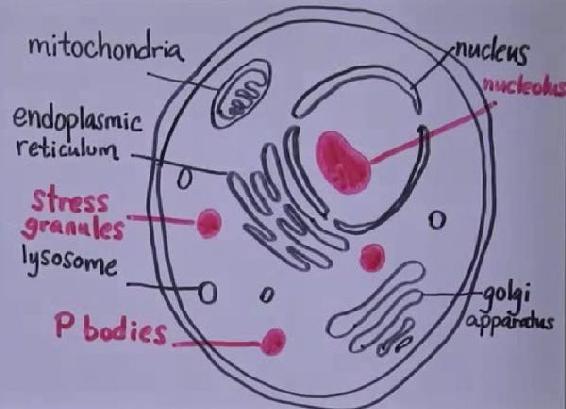
比如 P body. RNA granules. nucleolus(核内小体)。
它们也自成一体,但却没有一个膜包在外面。成分组成上,一般是一些蛋白质和 RNA 裹在一起,都是水溶性的物质,却不会分开,也不会打散了「溶解」在细胞质里。
这是一种怎样的物理结构哩。
2009 年,德国的 Hyman 实验室,第一次表明,在线虫细胞里的 P body,具有「液滴」(liquid drops)的性质。这就好比在水里的一滴一滴的油滴一样。油和水可以共存在一个体系里,但却不会互相融合。
判断是否具有液滴属性有三个基本标准:
1.形态:在正常、未有外力的情况下,表面张力导致液滴呈球形。
2.流动性:在液滴里的物质(RNA/蛋白质)应当可以无阻隔地任意流动。
3.结合性:两滴液滴互相靠近的时候,应当能够结合成一个新的大液滴。
有兴趣的同学可以研究下这篇文章(http://www.ncbi.nlm.nih.gov/pubmed/19460965 )
后来几年,陆续又有报道表明,nucleoli 和一些其他的 RNA granules 也是一种「液滴」的存在。(http://www.ncbi.nlm.nih.gov/pubmed/21368180 )
那么,是什么原因导致这样液滴的形成的呢?
研究这一问题的重要人物当属 UT Southwestern 的 Dr. Steven McKnight。McKnight 实验室首先于 2012 年发现:在试管中,提纯出来的一些蛋白质会在不同温度条件下,从液态变成水凝胶(hydrogel)的状态(水凝胶就是一种类似果冻的质地)。这些蛋白质都具有一个特性,都具备结合 RNA 的能力(RNA binding protein)。在氨基酸组成上,它们都有一段相似的序列结构,被称之为「LC domain」。(参考文献: sciencedirect.com 的页面)
把这个报道和之前的研究结合在一起,就有了一些很有意思的假说。因为细胞里大部分的这种「液滴」,里面的主要成分都是 RNA 和可以结合 RNA 的蛋白质,有很多都具有 LC 结构,那么会不会这些蛋白质的性质导致了「液滴」的存在,甚至在不同条件下,也可以像在试管里一样,从液滴变为凝胶状呢?
于是来到了 2015 年。首先,相继有井喷式的数篇报道验证表明了某些蛋白质可以在「液滴」、凝胶之间转换(http://www.ncbi.nlm.nih.gov/pubmed/26455390 ; http://www.ncbi.nlm.nih.gov/pubmed/26412307 ; http://www.ncbi.nlm.nih.gov/pubmed/26317470; http://www.ncbi.nlm.nih.gov/pubmed/26544936; cell.com 的页面)。这些报道不仅验证了 McKnight 2012 年在试管里的实验,并且直接在细胞体内也观测到了液滴形态的存在。更进一步的是,这些液滴在一定的条件下,可以大量聚集在一起,形成固态的沉淀和纤维状突起。比如这样(Patel et al., 2015):

液滴 大液滴 纤维状沉淀
来张纤维沉淀的特写:

活像一颗大海胆 :D
最勾起人们 G 点的是,这个海胆样的家伙大家以前见过,在老年痴呆患者的神经细胞里,满是这玩意。虽然是另外一种蛋白质(Abeta amyloid),但科学界的普遍看法是,正常情况下这种蛋白在细胞里好好的,慢慢地却会变质,会相互之间聚集在一起,从细胞质里沉淀出来,并且形成上图一样的发散形状的纤维结构。这种结构对细胞有毒,会渐渐杀死神经细胞。等脑子里的神经细胞死到一定数量,人就痴呆了。
不过在这一系列研究里,研究的对象并不是老年痴呆症里的这种 Abeta,而是具有结合 RNA 能力的一些蛋白,例如:FUS,hnRNPA1 和 hnRNPA2。这里重点讲一下 FUS。FUS 是一个和疾病有关的蛋白。FUS 基因的突变会导致一种神经退行性疾病:肌萎缩性侧索硬化(amyotrophic lateral sclerosis,ALS),俗称渐冻人症。主要病理为运动神经的逐渐死亡,随之带来肌肉萎缩、无法控制、瘫痪和呼吸困难(就跟霍金那样)。
有意思的是,之前提到的这几篇研究里都表明,带有 ALS 突变的 FUS 蛋白,相较于正常的 FUS,更容易自发地从液滴态聚集成沉淀,并且更难返回到液滴态。在正常液滴的模式下,蛋白和蛋白之间的互相作用和流动,以及它们所催化的生物反应,极有可能在形成固态沉淀之后,就变得缓慢甚至无法完成了。可以想象的是,因突变而异常的 FUS 功能受损,有可能影响到整个液滴作为一个独立的工作单元的生物职能,甚至最后导致了细胞的紊乱和凋亡,进而表现为疾病。其实不仅是 ALS,还有很多神经疾病,包括帕金森、舞蹈症、疯牛病等等,病理都显示有类似毒性的沉淀。所以这里研究的 FUS 沉淀的机理,可能同样适用于这些其他疾病。不过需要指出的是,FUS 沉淀和 Abeta 沉淀在性质上还是有差别的。(ALS/FTD Mutation-Induced Phase Transition of FUS Liquid Droplets and Reversible Hydrogels into Irreversible Hydrogels Impairs RNP Granule Function: Neuron)
综上,关于蛋白质液滴形态的发现,不仅开创了对非膜包裹的亚细胞结构机理的研究,在人类认识细胞运作的研究中有着巨大突破:更揭示了一个可能的导致神经疾病的机理。如果可以用一定手段减缓或者阻止液滴-->沉淀的反应,相信这会是一条很有希望治疗这些疾病的途径。
——————
- 放眼整个生物/生物工程领域,毫无疑问 CRISPR 是当下最火最前沿的发现和突破,具体的在 @Yang Liu 的回答(https://www.zhihu.com/question/38283839/answer/78337143 )里已经很详尽了。
- 我在这里提两个基础的生命科学,具体来说是神经科学里的新发现。这两个研究还处在科学发现和研究阶段,暂时还没有医药的应用,虽然本人非常坚信它们日后不管是对人类了解生命本身,还是在医疗治病方面,都会有极大的重要性。
- 需要指出的是,两项研究都并非一夜之间从无到有,而是像 CRISPR 和大部分科学成果一样,都经历了起码几年的从原始发现,到更多的证据支持,直到在业内被认可其真实性和重要性的过程。
- <写得简直跟一段难啃的木头一样>
- 原谅鄙人拙劣的生物中文。
2016-01-02
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。













