存在于细胞内,能够传递特定调控信号的化学物质称为细胞内信息物质。主要有第二信使、信号酶、信号蛋白和一些蛋白质相互作用结构域。
(一)第二信使
第二信使(second messenger)是在细胞内传递信息的小分子化学物质。
1.主要类型与特点
(1)主要类型。①环核苷酸类:如cAMP和cGMP;②脂类衍生物:如二酯酰甘油(diacylglycerol,DAG)、三磷酸肌醇(inositol triphosphate,IP3)、花生四烯酸、神经酰胺(ceramide,Cer)等;③无机物:如Ca2+;④气体分子:如NO等。
(2)主要特点::①多为小分子,且不位于能量代谢途径的中心;②在细胞外信号的作用下,分子在细胞中的浓度或分布可以迅速地改变;③作为变构效应剂可作用于相应的靶分子,已知的靶分子主要为各种蛋白激酶;④该分子类似物可模拟细胞外信号的作用;⑤阻断该分子的变化可阻断细胞对外源信号的反应。
2.cAMP的生理作用 cAMP是第一个被发现的第二信使。20世纪50年代,E.W.Sutherland在研究糖原酵解第一步所需限速酶——磷酸化酶的活性时发现,把肾上腺素加入肝组织切片后,能加速肝糖原分解为葡萄糖,而且分解肝糖原的磷酸化酶活性明显升高,因此断定磷酸化酶为催化肝糖原分解的限速酶,而肾上腺素能激活此酶。但是,当他把肾上腺素与纯化的磷酸化酶一起保温时,却没有激活作用。这提示肾上腺素激活磷酸化酶是一个间接过程,需要肝细胞中的某种因子协助。在随后的实验中发现,如果将ATP、Mg2+加入肝匀浆中,再加入肾上腺素或胰高血糖素一起保温,磷酸化酶又被激活。而把肝匀浆离心,取其上清液用于实验,肾上腺素的激活作用再次消失;只有加入沉淀物(含有细胞膜),才又恢复激活效应。他们证实,在补充了ATP和Mg2+的细胞匀浆沉淀中,有一种耐热因子,它存在于细胞匀浆的可溶性部分,能使磷酸化酶转变为活性形式,并最终在1960年确定这种物质是环磷酸腺苷(cAMP)。他认为人体内各种含氮激素(蛋白质、多肽和氨基酸衍生物)都是通过细胞内的cAMP而发挥作用的。1965年Sutherland提出第二信使学说,并因此获得1971年诺贝尔生理学和医学奖。第二信使学说具有划时代的意义,其主要内容是:①一种激素(或一种递质)的作用,是把分泌细胞的调节信息带到靶细胞,它们不能进入细胞内部,是“第一信使”;②激素与细胞膜上专一性受体结合,随即激活腺苷酸环化酶系统;③在Mg2+存在条件下,激活的AC使ATP生成cAMP;④细胞内cAMP浓度的变化,使这些细胞所特有的代谢活动发生,表现出各种生理效应。
第二信使是第一信使作用于靶细胞后在胞质内产生的信号分子,一旦生成,迅速通过下游的信号转导进行级联放大,最终产生生理效应。已知的第二信使种类不多,但却能传递多种细胞外的不同信息,调节不同的生理生化过程,这说明细胞内的信号通路具有通用性。
在细胞核内还有一类可与靶基因特异序列结合蛋白质。它们负责传递细胞核内外信息,调节基因的转录,发挥着转录因子或转录调节因子的作用,被称为第三信使,也称为DNA结合蛋白。如立早基因(immediate early genes,IEGs)编码的蛋白质。立早基因是一组在受到一系列外界刺激后迅速并且短暂激活的基因。目前为止,已在细胞中发现40多种。最早发现的包括c-fos,c-myc和c-jun等原癌基因,其表达产物主要包括转录因子(transcription factor)、DNA结合蛋白(DNA binding protein)、分泌蛋白、细胞骨架蛋白以及受体的亚单位,可作为第三信使参与基因调控、细胞增殖与分化、肿瘤的形成等。
(二)信号酶
1.蛋白激酶 细胞内大部分的生命过程,如代谢、物质转运、黏附、生长、发育、凋亡、免疫细胞激活、神经活动、应激和肿瘤的发生都涉及蛋白磷酸化,而且蛋白磷酸化也是多种信号转导途径中极其重要的环节。
蛋白激酶是一类磷酸转移酶,其作用是将ATP的γ-磷酸基转移到底物特定的氨基酸残基上,使蛋白质磷酸化,是许多第二信使直接作用的靶分子。有些蛋白质在磷酸化后具有活性,有些则在磷酸化后失去活性,通过磷酸化可调节蛋白质的活性。另外,通过蛋白质的逐级磷酸化,可以使信号逐级放大,引起细胞反应。目前已鉴定出518个人蛋白激酶的基因,它们在结构上都有保守的催化结构域(亚基)、调节结构域(亚基)和其他一些功能结构域。这些亚基分别被称为催化亚基和调节亚基,调节亚基与酶分子在亚细胞中的定位、酶的活性调节和酶与细胞内其他蛋白质之间的相互作用等关系密切。根据磷酸化的氨基酸残基不同,真核细胞蛋白激酶可分为5类(表10-2)。①丝氨酸/苏氨酸蛋白激酶;②酪氨酸蛋白激酶;③组/赖/精氨酸蛋白激酶;④半胱氨酸蛋白激酶;⑤天冬氨酸/谷氨酸蛋白激酶。
表10-2 蛋白激酶的种类
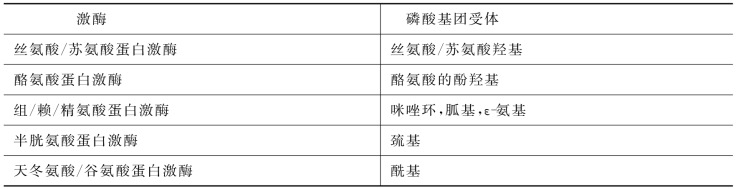
目前,对丝氨酸/苏氨酸蛋白激酶和酪氨酸蛋白激酶的结构和功能了解较多。细胞内重要的丝氨酸/苏氨酸蛋白激酶主要包括受环核苷酸调控的蛋白激酶A(protein kinase A,PKA)和蛋白激酶G(protein kinase G,PKG)、受DAG/Ca2+调控的蛋白激酶C(protein kinase C,PKC)、受Ca2+/CaM调控的钙调蛋白依赖型蛋白激酶、受PIP3调控的蛋白激酶B(protein kinase B,PKB)、受细胞周期蛋白调控的细胞周期蛋白依赖蛋白激酶(cyclin dependent protein kinase,CDK)及丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)。
2.蛋白磷酸酶 磷酸化和去磷酸化是绝大多数信号通路可逆激活的共同机制,磷酸化反应由蛋白激酶催化,而去磷酸化则由蛋白磷酸酶(protein phosphatase,PP)催化。在信号转导过程中,磷酸化主要与信号的启动、传递和放大有关,而去磷酸化主要与信号的终止和失活有关。无论蛋白激酶对于其下游分子的作用是正调节还是负调节,蛋白磷酸酶都将对蛋白激酶所引起的变化产生衰减信号,即产生使正调节减弱的负向信号,或产生使负调节减弱的正向信号。
与蛋白激酶催化磷酸化反应类似,蛋白磷酸酶亦具有底物特异性。根据作用的氨基酸残基不同,蛋白磷酸酶可分为磷酸丝氨酸/磷酸苏氨酸蛋白磷酸酶(protein serine/threonine phosphatase,PSTP)、磷酸酪氨酸蛋白磷酸酶(protein tyrosine phosphatase,PTP)和对上述两类磷酸化蛋白都有作用的双重磷酸化蛋白磷酸酶(可同时作用于酪氨酸和丝氨酸残基)。蛋白激酶和蛋白磷酸酶均作用于有限的底物,它们催化作用的特异性及其在细胞内的分布特异性决定了信号转导途径的精确性。
(三)信号蛋白
信号蛋白是细胞膜上或细胞内能够传递特定信号的蛋白质分子,常与其他蛋白质或酶构成复合体以传递信息。如GTP结合蛋白(G蛋白)、连接蛋白(SOS,GRB2)、鸟苷酸交换蛋白(GEF)、GTPase激活蛋白(GAP)、及Ras蛋白、衔接蛋白和支架蛋白等。
1.G蛋白 GTP结合蛋白(GTP binding protein,G protein)的简称,是具有GTPase活性的蛋白质,即能与GTP结合,水解GTP生成GDP,是细胞外信号通过膜受体进入细胞内的重要转导分子。自从Sutherland提出第二信使学说以后,人们普遍认为激素是直接激活腺苷酸环化酶。20世纪70年代,美国费吉大学的Gilam研究小组证实能激活腺苷酸环化酶的是一种蛋白质,这种蛋白质也受到GTP的刺激。
G蛋白是由α、β和γ亚基聚合在一起形成的异源三聚体,存在于细胞膜的胞浆侧(图10-8)。其中,α亚基最大,分子量在34~46ku,具有可与受体结合并受其活化调节的部位、与βγ亚基结合的部位、与GDP或GTP结合的部位以及与下游效应分子相互作用的部位等多个功能位点,此外还具有GTP酶活性。
在各种G蛋白中,差别最大的是α亚基,目前已发现20余种。根据G蛋白下游酶的种类或激活、抑制状态,将α亚基分为αs、αi、αq、αt、αg和α12。相应的G蛋白也被分为6个亚族(表10-3)。

图10-8 异源三聚体G蛋白
表10-3 哺乳动物G蛋白的主要类型及功能
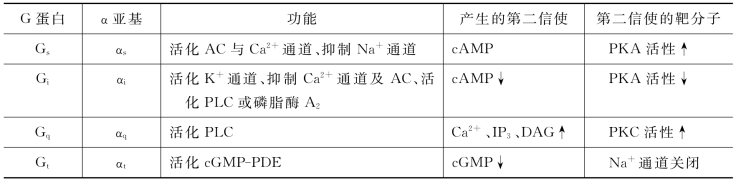
β和γ亚基亦有数种,但不及α亚基种类多。在细胞内,β和γ亚基形成紧密结合的二聚体,只有在蛋白变性条件下方可解离,因此可以认为它们是功能上的单体。βγ亚基的主要作用是与α亚基形成复合体并定位于细胞膜胞浆侧。近年来的研究表明,活化的βγ亚基复合物也可直接激活胞内靶分子,具有传递信号的功能,如心肌细胞中G蛋白偶联受体在结合乙酰胆碱刺激下,活化的βγ亚基复合物能开启质膜上的K+通道,改变心肌细胞的膜电位。此外βγ亚基复合物也能与膜上的效应酶结合,对结合GTP的α亚基起协同或拮抗作用。
G蛋白有两种构象,一种是以αβγ三聚体,并与GDP结合的形式存在,称为非活性型;另一种是α亚基与GTP结合,并与βγ亚基分离,称为活性型。当物理或化学信号刺激受体时,受体活化G蛋白使之发生构象改变。α亚基与GDP的亲和力下降,由GTP取代GDP。在结合了GTP后α亚基与βγ亚基解离,成为活化状态的α亚基。α亚基进一步激活细胞内的效应分子传递信号。由于α亚基具有GTP酶活性,可将GTP水解为GDP,此时,α亚基又再次与βγ亚基形成三聚体,回到非活性型,重新接受新的化学信号,G蛋白的这种活性型和非活性型的转变称为G蛋白循环(图10-9)。

图10-9 G蛋白循环
2.小分子G蛋白 小分子G蛋白(small G protein)因分子量只有G蛋白的1/4~1/3(20~30ku)而得名。第一个被发现的小G蛋白是Ras蛋白,是原癌基因ras的产物。由大约170个氨基酸残基构成的一条多肽链,分子量较小,大约21ku,这一类蛋白质被称为Ras超家族。Ras蛋白是膜结合型蛋白,性质类似于G蛋白的α亚基,具有与GDP和GTP结合的部位及GTP酶活性,是PTK信号转导通路中的主要成员。
目前已知的Ras超家族成员已超过60种,根据其同源程度分为Ras、Rho、Arf、Sar、Ran和Rab 6个亚家族,在细胞内分别控制不同的信号转导途径。由于它们均由一个GTP酶结构域构成,亦被称为Ras样GTP酶。
小G蛋白在多种细胞反应中具有开关作用,它们位于MAPK系统的上游,是一类重要的信号转导分子。其共同特点是:①结构相对简单,小G蛋白是单亚基蛋白,分为4个结构域,具有GTP酶作用位点和GDP/GTP结合位点;②调节范围有限;③信号转导时需要其他蛋白辅助,如细胞中存在着一些专门控制小G蛋白活性的调节因子,调节小G蛋白活性,小G蛋白再作用于MAPK系统。在这些调节因子中,有的可以增强小G蛋白的活性,如鸟嘌呤核苷酸交换因子(guanine nucleotide exchange factor,GEF)和鸟嘌呤核苷酸解离抑制因子(GDP dissociation inhibitor,GDI);有的可以降低小G蛋白活性,如GTP酶激活蛋白(GTPase activating protein,GAP)等。与G蛋白类似,当结合了GTP时小G蛋白成为活化形式,可活化下游分子,而当GTP水解成为GDP时则成为非活化状态。G蛋白在与GTP结合后,其GTP酶活性立刻发挥作用,水解GTP。但小G蛋白的GTP酶活性较低,生理条件下不能及时分解GTP。GAP能与Ras-GTP结合而激活GTP酶活性,使Ras-GTP转变为Ras-GDP(图10-10)。
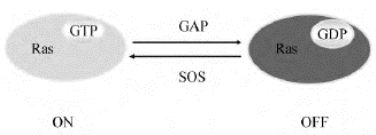
图10-10 Ras的活化及其调控因子
3.SOS蛋白(son of sevenless,SOS) 是一种鸟嘌呤核苷酸交换因子,能与GRB2的SH3结构域以及Ras蛋白结合,并使原来与Ras结合的GDP交换成GTP。当受体酪氨酸激酶被激活后,通过GRB2的作用;使原来在细胞质中的SOS移位至细胞膜的胞质面,接近膜结合的Ras。
4.衔接蛋白(adaptor protein) 能连接上下游信号分子,募集和组织信号转导复合物的形成,是信号转导通路中不同信号分子的接头。分子内含有蛋白质相互作用结构域是其发挥作用的结构基础。大部分衔接蛋白含有2个或2个以上的蛋白质相互作用结构域。如表皮生长因子受体信号转导通路中的衔接蛋白GRB2。GRB2是生长因子受体结合蛋白2(growth factor receptor-bound protein 2),结构中含有1个SH2结构域和2个SH3结构域,能够直接与激活的表皮生长因子受体磷酸化的酪氨酸结合,参与EGF受体介导的信号转导。
5.支架蛋白(scaffolding protein) 带有多个蛋白质相互作用结构域,可同时结合多个位于同一信号转导通路中的蛋白质。这样既保证了相关信号分子容纳于一个隔离而稳定的信号转导通路内,避免与其他通路发生交叉反应,维持信号转导的特异性,又能增加调控的复杂性和多样性。
(四)蛋白质相互作用结构域
细胞中存在着众多的信号转导分子,它们是如何相互识别、相互作用并构成不同的细胞转导途径的呢?20世纪90年代以来,人们逐步发现了信号分子中的一些特殊的结构域。这些结构域由50~100个氨基酸构成,具有很高的同源性,在细胞中介导蛋白质的相互识别和结合,形成信号转导复合物,被称为蛋白质相互作用结构域(protein interaction domain)。
1.SH2结构域 即Src同源序列2结构域(Src Homology 2domain),因其与蛋白质Src同源性高而得名。约由100个氨基酸组成,主要存在于多种胞质信号蛋白中,如PIP2特异性PLC、磷脂酰肌醇3激酶的调节亚单位、调节Ras活性的GAP以及crk、abl、vav等原癌基因产物。SH2结构域能识别靶蛋白中磷酸化的酪氨酸残基及其周围氨基酸残基组成的模体,并与磷酸化酪氨酸的磷酸基团结合。磷酸化酪氨酸残基C末端的1~6个氨基酸序列决定了其特异性。含有SH2结构域的蛋白质可专一性地识别与之结合的模体。这种高度亲和力和特异性保证了信息特异而有序地转导。
2.SH3结构域 由50~100个氨基酸组成,见于多种胞质信号蛋白及肌动蛋白结合蛋白中,如肌球蛋白及酵母骨架蛋白。介导信号分子与富含脯氨酸的蛋白分子的结合。一个蛋白分子中可含有一个或多个SH3结构域,能够识别富含脯氨酸的9个或10个氨基酸序列,亲和力与此序列中脯氨酸周围的氨基酸模体序列有关。目前,已发现多种含有SH结构域的蛋白质,如GAP、磷脂酶C-γ、类Src非受体型蛋白酪氨酸激酶(Src-like nonreceptor protein tyrosine kinase)、IRS-1等。这些蛋白质都具有SH2和SH3结构域。在这些蛋白质中有些是酶蛋白,如GAP、PLC-γ等,有的只是作为一种“连接器”。如生长因子受体结合蛋白(growth factor receptor bound protein 2,GRB2),它的SH2结构域与上游酪氨酸激酶受体结合,含有的2个SH3结构域与下游SOS结合,是连接酪氨酸激酶受体和其他蛋白质的桥梁,可将信号向下游转导。
3.PH结构域 是血小板蛋白同源序列(pleckstrin homology domain),由100~200个氨基酸组成。目前已知它可以与G蛋白相互作用,如β-肾上腺素能受体激酶中的PH结构域可与G蛋白中βγ亚单位结合,在G蛋白不同亚基识别中起关键作用。此外,该结构域可与磷脂类分子PIP2、PIP3、IP3等结合。
4.PTB结构域(protein tyrosine binding,PTB) 也称为磷酸化酪氨酸结合结构域(phosphotyrosine binding domain),由约160个氨基酸组成,与SH2一样,PTB结构域也可以识别靶蛋白中磷酸化酪氨酸残基及其周围氨基酸残基组成的特殊结构模体,并与磷酸化酪氨酸残基的磷酸基团结合,但其结合模体与SH2结构域有所差别。PTB结构域主要存在于接头蛋白中,将其他信号蛋白募集到激活受体的附近。
5.主要特点 这些蛋白质相互作用结构域在结构和功能上具有一定特点。
(1)一个信号分子可以含有两种以上的蛋白质相互作用结构域(图10-11),故可同时与两种以上的其他信号分子相结合,如在蛋白酪氨酸激酶Btk中有SH2、SH3和PH 3个结构域。
(2)同一类结构域可存在于多种不同的信号转导分子中,如PH结构域存在于某些蛋白激酶、低分子量G蛋白调节分子及细胞骨架蛋白等多种信号转导分子中,这些调控结合元件的一级结构仍然是不同的,因此对所结合的信号分子具有选择性,这是保证信号分子相互作用具有特异性的基础。
(3)这些结构域本身均为非催化结构域。目前已确认的蛋白质相互作用结构域超过40种(表10-4)。
表10-4 几种蛋白质相互作用结构域及其识别模体

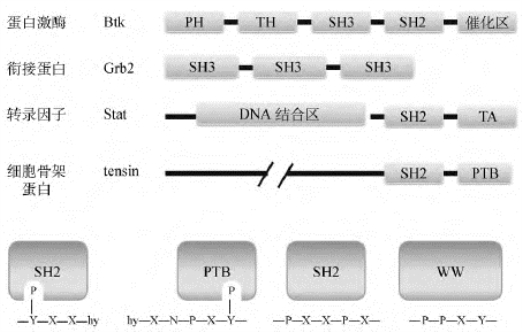
图10-11 信号转导分子中的调控结合结构域的作用及分布
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














