实验九 等电聚焦测定蛋白质等电点
【实验目的】
1.了解等电聚焦的基本原理。
2.了解等电聚焦的应用。
【实验原理】
等电聚焦(isoelectric focusing,IEF)目前已广泛用于蛋白质分析和制备中,是20世纪60年代后才迅速发展起来的重要技术。IEF的基本原理是,在电泳槽中放入两性电解质,如脂肪族多氨基多羧酸(或磺酸型、羧酸磺酸混合型),pH值范围有3~10、4~6、5~7、6~8、7~9和8~10等。电泳时,两性电解质形成一个由阳极到阴极逐步增加的pH值梯度,正极为酸性,负极为碱性。蛋白质分子是在含有载体两性电解质形成的一个连续而稳定的线性pH值梯度中进行电泳。样品可置于正极或负极任何一端。在电场中,蛋白质分子在大于其等电点的pH值环境中以阴离子形式向正极移动,在小于其等电点的pH值环境中以阳离子形式向负极移动。当置于负极端时,因pH>pI,蛋白质带负电向正极移动。随着pH值的下降,蛋白质负电荷量渐少,移动速度变慢。当蛋白质移动到与其等电点相应pH值位置上时即停止,并聚集形成狭窄区带。
如果在pH值梯度的环境中将含有各种不同等电点的蛋白质混合样品进行电泳,不管混合蛋白质分子的原始分布如何,都将按照它们各自的等电点大小在pH值梯度中相对应位置聚集,最终使不同等电点的蛋白质分子分隔在不同区域,这种按等电点大小在pH值梯度某一位置进行聚集的行为即是聚焦。聚焦部位的蛋白质质点的净电荷为零,测定聚焦部位的pH值即可知道该蛋白质的等电点。因此,IEF中蛋白质的分离取决于电泳pH值梯度的分布和蛋白质的pI,而与蛋白质分子大小和形状无关。
IEF的优缺点。优点:①分辨率很高,可把pI相差0.01的蛋白质分开。②样品可混入胶中或加在任何位置,在电场中随着电泳的进行区带越来越窄,克服了一般电泳的扩散作用。③电泳结束后,可直接测定蛋白质pI。④分离速度快,蛋白质可保持原有生物活性。缺点:①电泳中应使用无盐样品溶液,否则高压中电流太大而发热。但无盐时有些蛋白质因溶解性能差易发生沉淀,克服方法是在样品中多加些两性电解质。②许多蛋白质在pI附近易沉淀而影响分离效果,可加些脲或非离子去垢剂解决。
两性电解质载体有AmPholine(LKB公司)、Servalyte(Serva公司)、Pharmalyte(Pharmacia公司)及国内产品。两性电解质载体的选择主要依据被测蛋白质的大概等电点范围。
【实验器材】
玻管(Φ0.5 cm×10 cm或Φ0.25 cm×10 cm)、圆盘电泳槽、直流电源、注射器、玻璃平皿、直尺、刀片、两面板、parafilm封口膜、1.5 ml的EP管等。
【药品试剂】
1.40%蔗糖。
2.30%丙烯酰胺。
3.Ampholine两性电解质载体(pH3.5~10)。
4.10%过硫酸铵。
5.TEMED。
6.待测蛋白质溶液(如2 mg/ml的牛血清白蛋白溶液)。
7.20 g/L的NaOH溶液、5%磷酸溶液、12%三氯乙酸溶液。
【实验方法】
1.配胶前准备工作:取2支玻璃管(Φ0.5cm×10cm或Φ0.25cm×10cm),用Parafilm封口膜(或乳胶橡皮)紧紧与一端管口相贴以保证封闭管口。封端朝下作为管底,垂直放置在制胶管架上,加入40%蔗糖3~4滴。
2.小烧杯内按表3-10所示顺序分别加入试剂,混匀后,将凝胶液加入玻璃管中,直至离玻管顶端1 cm处为止,上面再以2~3滴蒸馏水覆之。注意不要搅动凝胶,保持其表面平整。室温静置进行聚合,当凝胶与水之间出现清晰界面时,表示聚合完成。
表3-10 等电聚焦中凝胶的配置

3.剥去封胶的Parafilm,甩掉玻璃管两端的水和蔗糖液,用少量蒸馏水洗涤两端残留的未聚合聚丙烯酰胺,将玻璃管插入圆盘电泳槽的胶塞孔中。将所有胶塞孔都插满玻管,如果没有多的玻管,用未开孔胶塞封闭样品槽。
4.将样品槽翻转,用注射器吸取少量NaOH溶液,加入玻管内,以排出气泡。
5.向样品槽(圆盘电泳槽上槽)内加入少量5%磷酸溶液,溶液量淹没过胶塞面即可,观察是否漏液。如果漏液,需重新插管。如果不漏液,继续加磷酸溶液,直至淹没过玻管上缘。
6.向圆盘电泳槽下槽加入20 g/L NaOH溶液,液面淹没过玻管下缘即可。
7.放入样品槽,加盖,上槽接正极,下槽接负极,打开直流电源,恒压160 V,聚焦约4小时,当电流接近零时停止电泳。
8.聚焦结束后取出凝胶管,先用蒸馏水洗涤两端,然后用带长针头的注射器吸取水,插入胶柱与玻璃管内壁之间,缓慢旋转玻璃管,边旋转边注水,边推进针头,使凝胶条与管壁剥离,然后用洗耳球对玻璃管一端轻轻加压,使凝胶条从玻璃管内滑出,标明胶条正负端,并对凝胶条编号。
9.测量凝胶条长度L1和L1’并记录。
10.将一根凝胶条(长度为L1)放入培养皿中,加入12%三氯乙酸溶液固定,20分钟~2小时即可见到白色蛋白条带。
11.测量固定后的凝胶条长度L2,以及凝胶条正极端到蛋白质白色沉淀条带中心的距离Lp,并记录。
12.将另一条未经固定的凝胶(长度为L1’)按照从正极端到负极端的顺序用刀片依次切成5 mm长的小段,分别置于有1 ml蒸馏水的试管中浸泡过夜。次日用pH试纸测量溶液pH值,并记录。
13.绘制pH值梯度曲线:以凝胶柱长度为横坐标,pH值为纵坐标作图。由于所测得的每一管之pH值是5 mm长的小段胶条的pH值混合平均值,作图时应把此pH值视为5 mm小段的中心区pH值,即第一小段的pH值所对应的胶条长度应为2.5 mm,其余胶条段的长度依次按(5n~2.5)mm类推。
14.计算蛋白质样品等电点:根据蛋白聚焦部位距凝胶条正极端的实际长度tLp’,从pH值梯度曲线上查到对应pH值即为该蛋白的等电点(表3-11)。
表3-11 蛋白质样品等电点的计算
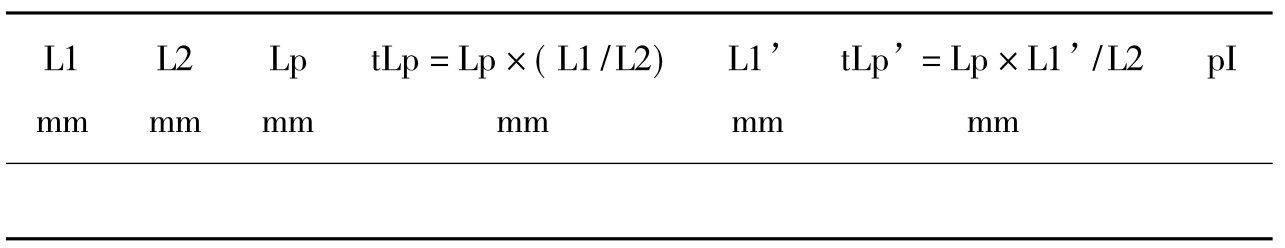
L1:凝胶柱固定前长度(mm);
L2:凝胶柱固定后长度(mm);
Lp:固定后蛋白质白色沉淀区带中心距凝胶柱正极端的长度(mm);
tLp:固定前蛋白质聚集部位距凝胶柱正极端的实际长度(mm);
L1’:未固定凝胶长度,即测定pH值那支凝胶的长度(mm);
tLp’:在未固定凝胶中待测蛋白质距凝胶柱正极端的实际长度(mm)。
pI:待测蛋白的等电点。
【注意事项】
1.样品要脱盐,否则区带扭曲;要彻底溶解,未彻底溶解的颗粒易引起拖尾;样品溶液中可加变性剂如尿素(6~8 mol/L)、去污剂等。加样量取决于样品中蛋白质种类及检测方法的灵敏度。一般以0.5~1 mg/ml蛋白质为宜,最适加样体积10~30μl,对不稳定样品可进行预电泳。
2.电极缓冲液应根据两性电解质pH值范围加以选择,可参见相应产品说明书。
3.样品可直接加在胶的顶部,亦可以在胶聚合前加入胶的混合物内一起聚合,须视样品的浓度及稳定性而定。如果样品比较浓,且易失活,一般在电泳前加到胶的顶部。为了不使样品接触电极溶液,在加样品后,再将胶管顶部充满1%两性电解质。样品也可以经预电泳后再加入,这也要看蛋白质样品对pH值的敏感程度。
【思考题】
1.简述等电聚焦法测定蛋白质等电点的原理。
2.简单叙述等电聚焦的应用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














