(一)σ因子控制特定基因的表达
σ因子与RNA聚合酶紧密结合,在转录起始阶段,合成8~10个核苷酸,σ因子随即解离,核心酶进入RNA延伸阶段。游离的σ因子本身并不能直接结合特定的DNA。不同的σ因子可以竞争结合RNA聚合酶。环境变化可诱导产生特定的σ因子,从而打开一套特定的基因,如σ32因子就是一个较典型的例子。
σ32由E.coli rpoH(或HtpR、hin)基因编码,分子量为32ku,控制热休克蛋白基因的表达。σ32的合成属于温度诱导型,30℃生长条件下,σ32的含量大约为50拷贝/细胞;温度升高(如42℃)时,4~6min就会增加到原来的17倍,随后又逐渐下降,大约15min后,稳定在原来的5倍左右。σ32的温度诱导合成的调控发生在翻译水平。在低温或稳定生长状态下,rpoH mRNA的翻译处于被阻遏状态,当温度突然升高时,阻遏被解除,开始大量翻译合成,σ32浓度增加,导致热休克蛋白的大量合成,产生热应激反应。几分钟后,E.coli基本适应高温环境,σ32的合成减少。
σ32对热休克蛋白基因表达的调控发生在转录水平。与通常的启动子相比,大多数热休克蛋白基因的一致性序列有类似的-35区序列,但-10区序列完全不同,而且两个一致性序列中间的间隔序列较短,不能被σ70-RNA聚合酶识别,只能被σ32-RNA聚合酶识别。
热应激发生时,由于游离的σ32浓度的大量增加,与σ70竞争结合RNA聚合酶,形成大量的σ32-RNA聚合酶,进而与热休克蛋白基因的启动子结合,大量转录mRNA,合成热休克蛋白。当E.coli适应热环境,进入稳定生长状态时,σ32减少,σ70-RNA聚合酶重新增多,又可以启动正常基因的表达。
(二)乳糖操纵子的转录调控
在大肠埃希菌的许多操纵子中,基因的转录不是由单一因子调控的,而是通过负调控因子和正调控因子进行复合调控的。比较典型的是一些与糖代谢有关的操纵子。
细菌通常优先以葡萄糖作为能源,当培养环境中有葡萄糖时,即使加入乳糖、阿拉伯糖等其他糖,细菌也不利用这些糖,不产生代谢这些糖的酶,直到葡萄糖消耗完毕,代谢其他糖的酶才会根据相应的糖是否存在而被诱导产生。这种现象称为“葡萄糖效应”。其原因在于葡萄糖代谢产物能抑制细胞腺苷酸环化酶和激活磷酸二酯酶的活性,结果使细胞内cAMP水平降低。当葡萄糖耗尽时,细胞内cAMP水平升高,即可通过CAP调控其他操纵子的表达。CAP和其他因子形成的复合调控作用,在乳糖操纵子和阿拉伯糖操纵子研究得较清楚。
1.阻遏蛋白的负性调节 前已述及E.coli的乳糖操纵子有3个结构基因Z、Y、A,分别编码β-半乳糖苷酶、半乳糖苷透酶、半乳糖苷乙酰化酶,在其上游由启动序列P、操纵序列O和CAP蛋白的结合位点共同构成乳糖操纵子的调控区。I基因是调节基因,编码产生阻遏蛋白,在无乳糖的情况下,它与操纵序列结合而阻断RNA聚合酶启动结构基因的转录,但这种结合并不完全,因此,会有微量的β-半乳糖苷酶、半乳糖苷透酶、半乳糖苷乙酰化酶的合成。
当有乳糖存在时,乳糖经透酶作用进入细胞,经残留的β-半乳糖苷酶催化,一小部分乳糖被异构化,变成别乳糖(allolactose,即半乳糖和葡萄糖以β1,6-糖苷键相连),别乳糖作为别构效应物与阻遏蛋白结合,改变阻遏蛋白的构象,使其不能再与操纵基因结合,引起结构基因的转录。
2.CAP的正性调节 lac操纵子中的lac启动子是弱启动子,其-35区与一致性序列相差甚远,RNA聚合酶与之结合的能力很弱,只有CAP结合到启动子上游的CAP结合位点后(图4-17),促进RNA聚合酶与启动子结合,才能有效转录。
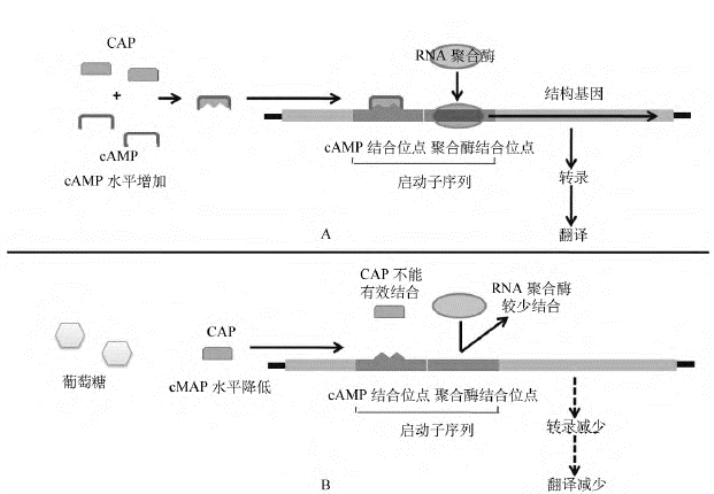
图4-17 CAP对乳糖操纵子的正调控
A.葡萄糖缺乏;B.葡萄糖存在
3.协调调节 乳糖操纵子的转录起始是由CAP和阻遏蛋白两种调控因子来控制的。乳糖操纵子之所以要受到双重调控,有两个原因:一是使细胞能够优先利用葡萄糖,而优先利用葡萄糖对细胞来说是有益的,因为参与葡萄糖分解的基因均是管家基因,这样葡萄糖可以迅速地被分解,为细胞提供能量;第二个原因是lac启动子序列与启动子的一致序列相差较大(图4-18),是一个弱启动子,而CAP-cAMP的激活就弥补了其启动子活性的“先天不足”。CAP和阻遏蛋白这两种因素,可因葡萄糖和乳糖的存在与否而有4种不同的组合。

图4-18 乳糖启动子序列和原核启动子一致序列的比较
(1)葡萄糖存在、乳糖不存在:此时无诱导剂存在,阻遏蛋白与操纵序列结合,并且由于葡萄糖的存在,CAP也不能发挥正调控作用,基因处于关闭状态。
(2)葡萄糖和乳糖都不存在:在没有葡萄糖存在的情况下,CAP可以发挥正调控作用。但由于没有诱导剂,阻遏蛋白的负调控作用使基因仍然处于关闭状态。
(3)葡萄糖和乳糖都存在:乳糖的存在对基因的转录产生诱导作用。但由于葡萄糖的存在使细胞内cAMP水平降低,cAMP-CAP复合物不能形成,CAP不能结合到CAP结合位点上,转录仍不能启动,基因处于关闭状态。
(4)葡萄糖不存在、乳糖存在:此时CAP可以发挥正调控作用,且阻遏蛋白由于诱导剂的存在而失去负调控作用,基因被打开,启动转录。
(三)阿拉伯糖操纵子的转录调控
阿拉伯糖操纵子(araoperon)编码3个与阿拉伯糖代谢有关的酶:阿拉伯糖异构酶(arabinose isomerase),催化阿拉伯糖异构成核酮糖,由araA基因编码;核酮糖激酶(ribulokinase),催化核酮糖的磷酸化,由araB基因编码;核酮糖-5-磷酸差向异构酶(ribulose-5-phosphate epimerase),由araD基因编码,催化核酮糖-5-磷酸异构成木酮糖-5-磷酸,使之进入磷酸戊糖途径。调控区由启动子(P)和起始区(araI)以及操纵元件(O)组成。araB、araA、araD三个结构基因共同受araC基因的产物AraC蛋白和CAP-cAMP控制(图4-19)。
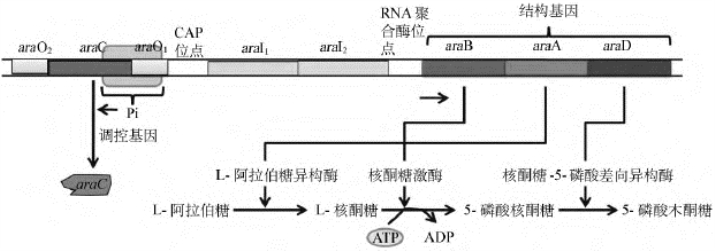
图4-19 阿拉伯糖操纵子的模型
AraC有3个不同的结合位点:araO1、araO2和araI,araO1位于araC启动子的上游;araO2位于araC基因的内部,远离araO1。AraC与3个结合位点的亲和力依次是araI≥araO2≥araO1。在ara操纵子的基因表达调控中,CAP蛋白主要起去阻遏作用,而不是正调控作用。当AraC蛋白单独存在时,结合到araO1、araO2和araI,表现为负调控作用;在阿拉伯糖的影响下,结合于araI的AraC蛋白变构,发挥正调控作用。基因表达抑制或激活的诱导因素是葡萄糖和阿拉伯糖(图4-20)。
(1)有葡萄糖,有或无阿拉伯糖:由于葡萄糖代谢的影响,cAMP水平很低,CAP失活,不能结合DNA,阿拉伯糖操纵子中的CAP结合位点是空的。而AraC蛋白同时结合于araI和araO2,将两个位点拉在一起,使DNA片段形成环,这是一种阻遏型构象。基因处于关闭状态。
(2)无葡萄糖,无阿拉伯糖:在无葡萄糖的情况下,细胞内cAMP水平升高,形成有活性的cAMP-CAP复合物,该复合物结合到CAP结合位点,改变结合在araI的AraC蛋白的活性。此时,AraC蛋白释放DNA的araO2位点,使环解开,阻遏状态解除。但由于此时无阿拉伯糖存在,AraC蛋白不能激活转录,基因仍处于关闭状态。
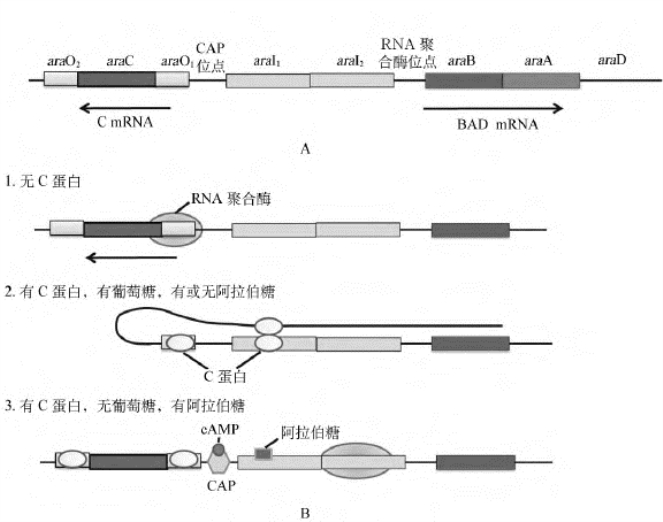
图4-20 阿拉伯糖操纵子的转录起始调控
A.阿拉伯糖操纵子的调控位点;B.阿拉伯糖操纵子的调控
(3)无葡萄糖,有阿拉伯糖:此时阻遏状态解除,阿拉伯糖与AraC蛋白结合,使AraC蛋白变构,进而促进RNA聚合酶与启动子结合,启动转录。
(四)色氨酸操纵子的转录调控
E.coli的色氨酸操纵子(trpoperon)有五个结构基因,编码合成色氨酸所需的酶。上游调控区由启动子(P)、操纵序列(O)和前导基因(L)组成。调控区上游还有调节基因R,编码阻遏蛋白。
1.阻遏蛋白的调控作用 一般来说,控制分解代谢的操纵子为诱导型,控制合成代谢的操纵子属于阻遏型。操纵子发生这样的分化使得细胞能够迅速对环境或细胞内部的代谢变化做出反应(图4-21)。
以色氨酸操纵子为例,如果培养基中含有色氨酸,那么大肠埃希菌只需要将它们运输到细胞内直接利用,而不必浪费能量自己制造。因此,这时候色氨酸操纵子就应该被关闭;相反,如果培养基中没有色氨酸,那么大肠埃希菌必须“自力更生”,自己制造它,以满足蛋白质合成对它的需要,这时候色氨酸操纵子应该被打开。
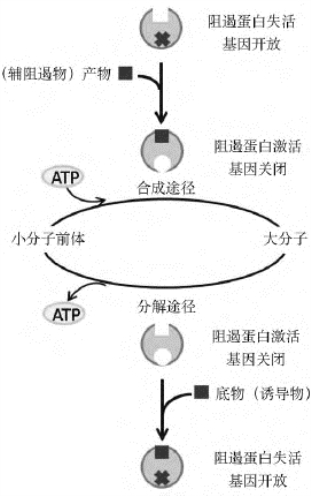
图4-21 分解代谢操纵子和合成代谢操纵子比较
Trp操纵子是一种阻遏型操纵子,无色氨酸时,阻遏蛋白不能与操纵基因结合,对转录无抑制作用;细胞内有较大量的色氨酸时,阻遏蛋白与色氨酸形成复合物后能与操纵基因结合,抑制转录(图4-14)。
2.trp操纵子的弱化(attenuation)作用 如果色氨酸操纵子是控制色氨酸合成有关酶基因表达的唯一手段的话,就不难设想,TrpR的缺失突变将导致色氨酸操纵子对培养基中加入的色氨酸不敏感,因为细胞内已没有感应色氨酸浓度变化的装置。然而,事实出乎人们意料,加入的色氨酸仍能够降低trpEDCBA基因的表达,这表明细胞内一定存在另外一种机制调节trpEDCBA基因的表达。
研究显示,第二种调节机制就是所谓的弱化子(attenuator)或称衰减子,它与tRNA(特别是色氨酰-tRNAtrp)和trpL基因有关。弱化子是一种更为精细的调节基因表达的模式,它建立在翻译和转录之间偶联的基础上,因此,为原核生物所特有。弱化子一般存在于参与蛋白质合成的操纵子中,与操纵子一起共同调节参与生物合成的酶基因的表达。
色氨酸操纵子的弱化子(图4-22)位于结构基因E和操纵序列(O)之间的L基因中,离E基因上游30~60个核苷酸。大肠埃希菌在无色氨酸的环境下,L基因和结构基因能转录产生具有6 700个核苷酸的全长多顺反子mRNA,当细胞内色氨酸增多时,结构基因转录受到抑制,但L基因转录的前导mRNA(140个核苷酸)并没有减少,这部分转录物称为衰减子转录物。衰减子转录的mRNA中具有4段特殊的序列,依次编号为1、2、3和4。这4段RNA有两种配对方式,一种是1与2和3与4之间配对,另一种是2与3配对,不同的配对导致形成的不同的茎环结构。3与4配对所形成的茎环结构之后紧接着寡尿嘧啶,是不依赖于σ因子的转录终止信号;如果2与3配对形成的茎环结构并非终止子。4个片段形成何种发夹结构,是由L基因转录物的翻译过程所控制的。L基因内部含有一段开放的阅读框架,编码一个由14个氨基酸残基组成的前导链,其中含有两个相邻的色氨酸密码子。这两个相邻的色氨酸密码子以及原核生物中转录与翻译的偶联是产生衰减作用的基础。trpL基因转录不久核糖体就与mRNA结合,并翻译L短肽序列。当细胞内有充足的色氨酸时,很容易形成色氨酰-tRNA,前导链的翻译持续下去,直至遇到终止密码子。前导链的顺利翻译致使2与3之间不能配对,但3和4之间可以配对形成发夹结构,即形成转录终止信号,从而导致RNA聚合酶转录终止。如果细胞内缺乏色氨酸时,色氨酰-tRNAtrp缺乏,核糖体就停止在两个相邻的色氨酸密码的位置上,片段1和2之间不能形成茎环结构,片段2和3之间配对形成大的茎环结构(非终止子),阻止了片段3与4配对形成弱化子,因为没有终止子,trpEDCBA基因可以继续转录下去。
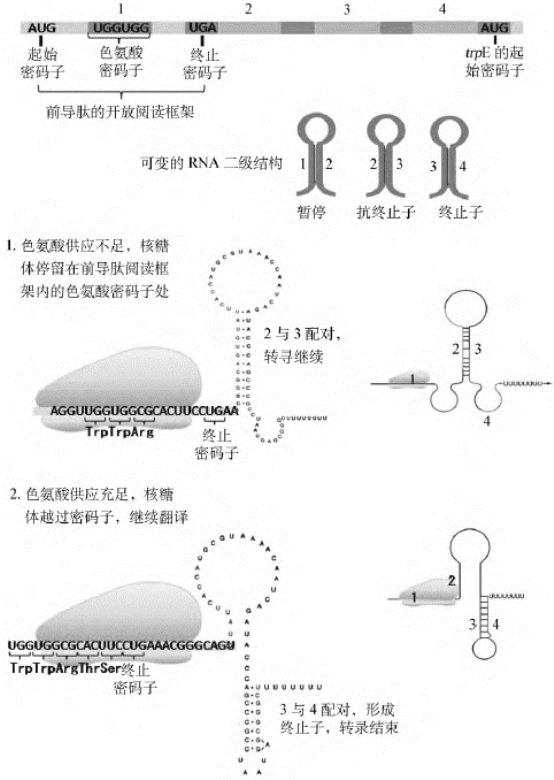
图4-22 色氨酸的弱化子模型
色氨酸操纵子中的操纵基因和弱化子可以起双重负调节作用。弱化子可能比操纵基因更灵敏,只要色氨酸一增多,即使尚未诱导阻遏蛋白结合操纵基因,通过弱化子就足可以使大量的mRNA提前终止。反之,当色氨酸减少时,即使失去了诱导阻遏蛋白的阻遏作用,但只要还可以维持前导肽的合成,仍继续阻止转录。这样可以保证尽可能充分地消耗色氨酸,使其合成维持在满足需要的水平,防止色氨酸堆积和过多地消耗能量。同时,这种机制也使细菌能够优先将环境中的色氨酸消耗完,然后开始自身合成。
细菌其他氨基酸合成系统的许多操纵子(如pheA,his,leu,thr等)也有类似的弱化子存在。
(五)DNA片段倒位对基因表达的调控
倒位蛋白(inversion protein)是一种位点特异性的重组酶(site-specific recombination enzyme)。关于倒位蛋白调控基因表达的作用,研究得较清楚的是鼠伤寒沙门菌的两种鞭毛蛋白(H1和H2)的表达。这两种鞭毛蛋白分别由两个基因编码,但是任何一个沙门菌细胞只会表达一种类型的鞭毛蛋白。在H2基因的操纵子中,存在两个结构基因—H2和rH1。rH1的编码产物专一性抑制H1基因的表达。当H2操纵子表达时,同时转录翻译出H1基因的阻遏蛋白rH1,使H1基因关闭(图4-23)。H2操纵子能否表达与其上游的长约1 000bp的DNA片段的方向有关,该片段含有Hin基因和H2基因的启动子,可发生位点特异性倒位(site specific inversion)。促进倒位序列翻转的酶是一种位点特异性重组酶,由Hin基因编码。当倒位基因Hin表达时,其表达产物可使上述片段倒位,启动子的方向转向基因的上游,不能启动H2基因的转录。在这种情况下,H2基因关闭,H1基因则因失去阻遏蛋白而开始表达,产生H1鞭毛蛋白。这种倒位重组的发生频率很低,大约在105次细胞分裂中才发生一次。
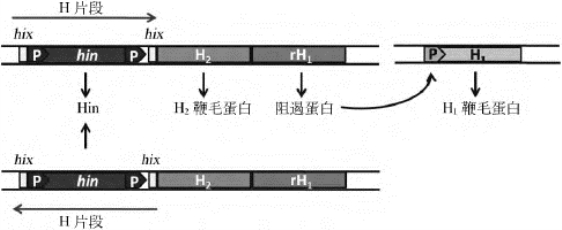
图4-23 DNA片段倒位对基因表达的调控作用
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















