1.共附生海洋微生物(symbiotic and epiphyticmarinemicroorganisms)
微生物在海洋中的分布非常广泛,在高盐、高压、高温、严寒的环境中都有微生物存在。它们有的自由生活在海水中,有的存在于一些沉淀物、海底泥的表面,还有一部分与海洋动植物处于共生、共栖、寄生或附生的关系中。迄今为止,已从这些共附生海洋微生物中发现了许多具有不同生物活性的物质,包括毒素、抗生素、抗肿瘤活性物质、酶类、色素等,并有许多已具有工业化生产价值。
共附生海洋微生物的宿主非常广泛,主要有藻类植物、蓝细菌、海绵动物、腔肠动物、尾索动物(被囊动物,如海鞘)、软体动物、须腕动物、棘皮动物、刺胞动物(如海葵)、节肢动物、鱼类等。目前发现的活性物质主要是在海绵、海鞘、甲壳动物、苔藓虫和裸鳃亚目动物中分离到的。据估计,20%~50%的海鞘或海参体内的微生物可产生具有细胞毒性或抑菌活性的化合物。海绵中的共生微生物约占海绵体积的40%,可从中获取多种生物活性物质。
海洋微生物与海洋动植物共附生是一个非常普遍的现象,有关此现象的描述也越来越多。但是对共附生海洋微生物与其宿主的确切关系了解不多。1988年Distel 等人报道了化能自养菌与生活在海底热液喷口的无脊椎动物的共生关系。他们认为海底火山口喷发的硫化物为化能自养菌提供所需的能量和还原力,而生活于海底火山口的无脊椎动物一般具有退化的消化道或根本没有消化道,因而不得不依靠与其内共生的化能自养菌来生存。海洋动植物宿主提供与其共附生的微生物营养环境以利于生长,而共附生微生物则产生多种活性物质以利于宿主生长代谢或对其提供化学保护。
随着研究的深入,很多文献报道指出,许多以前认为是由海洋动植物产生的活性物质实际上是由与其共附生的海洋微生物产生的。Yasumato和Baguchi等人分别在分离自红色钙藻Jania sp.的假单胞菌和分离自蟹Atergatis floridus的弧菌的培养物中发现了河鲀毒素tetrototoxin(TTX)。TTX是一种神经毒素,以前一直被认为是由海洋动物产生的,但是由于在多种海洋微生物提取物中发现TTX,因此TTX可能是来源于海洋微生物。
海绵体内有着非常复杂的微生物系统。许多与海绵共附生的微生物培养物中都分离到与海绵提取物相同或相似的物质。1994年Oclarit等从海绵Hyatella sp.制备的匀浆液中分离到一株弧菌,其发酵产物肽类抗生素andrimid也曾在该海绵的提取物中发现。Miki等从海绵Reniera japonica中分离出产生类胡萝卜素的屈挠杆菌属海洋细菌Flexibacter sp.。Yokoyama等从海绵中分离到一株黄杆菌属细菌,能够产生一种橙色色素myxol。
Tapiolas等人在采集于加利福尼亚海沟的一种珊瑚Pacifigugia sp.的表面分离到的链霉菌的培养物中发现了结构新颖的octalacions A和B。Takahashi等人在海鱼Halichkoeres bleekeri的胃肠道中分离到链霉菌Streptomyces hygroscopicus,此菌在人工海水培养基中可产生halichomycin—一种新的大环内酯类化合物。一种分离于巨大海藻Pocockiella variegeta的海洋革兰氏阴性嗜盐菌Pelagiobacter variabilis在海水培养基中30 ℃培养4h,可产生一种吩嗪类化合物pelagimicins,这种化合物能抗多种革兰氏阳性菌、革兰氏阴性菌,且在体外对Hela、Balb3T3、Balb3T3/H-ras细胞有显著的抑制作用。Yazawa等从太平洋鲐鱼中分离到的一株海洋细菌,可产生不饱和脂肪酸EPA(二十碳五烯酸),含量占总脂的24%~40%,占细胞干重的2%。
2.发光细菌(luminescent bacteria,luminous bacteria)
图1-4 海洋发光细菌在平板上的菌落特征
发光细菌在海洋系统中很常见,它们在海水中自由生活,或存在于有机物碎片上,或在许多海洋动物的肠道中共栖和作为发光器官的共生菌。常见的海洋发光细菌包括印度发光杆菌(Photobacterium indicum)、磷光发光杆菌(P.phosphorescens)、哈维氏弧菌(Vibrio harveyi)、费氏发光杆菌(P.fischeri),此外还有火神弧菌(V.logei)、灿烂弧菌(V.splendidus)、费氏弧菌(V.fischeri)、鳆发光杆菌(P.leiognathi)、羽田希瓦氏菌(Shewanella hanedai)、伍迪希瓦氏菌(S.woodyi)等(图1-4)。
寄生于南极虾等甲壳动物和一些大洋深层鱼的体表发光细菌,往往于宿主死后迅速生长,继而出现明显发光现象;这些寄生性发光细菌的发光现象,易于导致宿主被掠食性鱼类捕食,借此进入鱼的肠道生长繁衍,成为宿主肠道内的共栖细菌。
浮游型海洋发光细菌以哈维氏弧菌、费氏弧菌、鳆发光杆菌3种海洋细菌最为常见。Orndorff和Colwell从马尾藻海160~320m深的海水中分离出83株发光细菌,其中60%以上属于哈维氏弧菌,其余几乎都是费氏弧菌或鳆发光杆菌。加州沿岸表层水所含发光细菌中,哈维氏弧菌和费氏弧菌占99%以上;夏季时哈维氏弧菌占60%~70%,但冬季时此种几乎完全消失,剩下的几乎全部是费氏弧菌。Caccamo等对意大利西西里东北方的第勒尼安海(Tyrrhenian Sea)沿岸水的15株发光细菌分离株,进行了表型和分子生物学测试,结果显示,分离株虽可区分为4类表型或3类基因型,但都属于哈维氏弧菌。除了广泛分布于沿岸水域外,哈维氏弧菌常出现于海水养殖池,一旦感染池中鱼虾,往往给养殖场造成严重的损失;该菌也能通过污染海鲜类食品和饮水,成为人的病原菌。
费氏弧菌、鳆发光杆菌和明亮发光杆菌3种发光性海洋弧菌,常与海洋中特定鱼类及头足类形成紧密共生关系。它们密集生存于宿主发光器官内,借此获得比较安全而不缺乏营养的环境。宿主则可借助共生细菌发光,获得惊吓、驱退捕食者、诱捕饵料生物及“呼朋引伴”、求偶等效果。3种内共生发光细菌在浮游、体表附生或肠道内共栖状态下也都能生存繁衍,因此一般认为,发光器官与外界有相通管道,这些菌由此进出发光器官。有证据显示,鱼类和头足类发光器官的内共生发光细菌,并非得自亲代传承,而是子代于成长过程中从周围海水中获得的(图1-5)。
海洋发光细菌可被用作检测水域污染状况的指示生物,因为该菌的发光强度对毒性物质相当敏感,可受低浓度的环境污染物所抑制,抑制程度与受试物的毒性大小(种类)和浓度呈线性相关。图1-6是发光细菌对Cr6+、Hg2+和Cd2+三种重金属污染物的发光抑制效应。根据这一原理,我国国家环保局1995年发布了水质急性毒性的测定方法—发光细菌法。


图1-6 海洋发光细菌发光性能对重金属污染物的敏感性
关于海洋细菌发光的机制,已证实在发光细菌体内存在细菌荧光素酶(luciferase),能够催化长链脂肪醛、FMNH2和O2的氧化反应,发出最大发光强度在波长450~490nm处的蓝绿光(图1-7)。
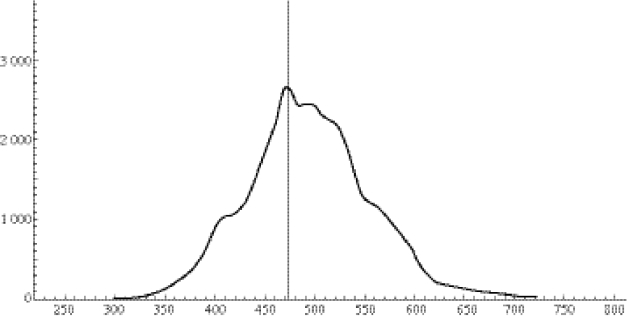
图1-7 费氏弧菌V.fischeri的特征发射波长
细菌发光的反应机制如图1-8所示,荧光素酶是一种具混合功能的氧化酶,能够同时催化还原态的黄素单核苷酸(flavinmononucleotide,FMNH2)和长链脂肪醛(RCHO)的氧化。所有发光细菌的荧光素酶都是由α(约40×103)和β(约35×103)亚单位构成的二聚体。反应式可表示如下:
FMNH2+RCHO+O2→FMN+RCOOH+H2O
如前所述,海洋细菌的发光现象也是群体感应系统表达的结果,即每一个海洋发光细菌产生少量的自诱导物分子并释放到环境中,当发光细菌感测到有足够浓度的自诱导物分子时,则所有细菌的发光基因开始启动表达,使我们看到发光现象。当在实验室的液体培养基中培养费氏弧菌时,细菌进入对数末期或稳定期且细菌的数目达到一定的密度(一般为107 cells/mL)时才发光。细菌的群体感应最先在海洋发光细菌费氏弧菌中发现。费氏弧菌通过检测自诱导分子而引起信号级联,最终导致发光(图1-8)。
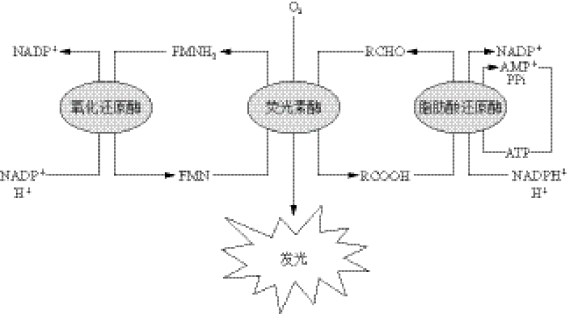
图1-8 细菌的发光反应(引自Munn,2003)
发光基因(lux gene)系统中包括结构基因luxC、luxD、luxA、luxB、luxE和调节基因luxI和luxR等。从不同发光细菌中分离得到的发光基因其种类和数量有所差异,如luxF仅发现于明亮发光杆菌,但以上5个结构基因普遍存在于已知的所有发光细菌中。编码荧光素酶的基因是luxA和luxB,以哈维氏弧菌为例,其luxA基因长1065bp,编码的α亚基是355个氨基酸的多肽,相对分子质量为40000;luxB基因长972bp,编码的β亚基是324个氨基酸的多肽,相对分子质量为36000。两亚基组成的荧光酶的相对分子质量为76000。发光现象由在不同操纵子的调控基因luxI和luxR控制,luxI编码发光细菌自诱导物因子合成酶,luxR编码发光系统的调节蛋白。图1-9中,a:代表在低细胞密度下的一个细胞,luxI和luxR基因的转录水平较低。b:代表随着细胞密度的增加,细胞周围的自诱导分子的浓度增加。调节蛋白LuxR是lux操纵子启动子的抑制因子,当LuxR与自诱导分子结合时,它与启动子上游的lux box紧密结合,并激活其右侧操纵子的转录,促进发光现象的产生。
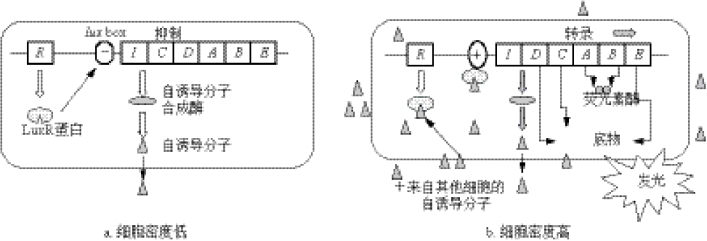
图1-9 费氏弧菌的密度感应(引自Munn,2003)
3.深海热液喷口微生物(microorganisms in deep-sea hydrothermal vents)
在一定的温度范围内,微生物的代谢活动与生长繁殖随温度的升高而升高,但当温度上升到一定程度,就会导致蛋白质变性、细胞膜溶化、DNA变性等,进而导致微生物的死亡。专性嗜热菌的最适生长温度在65℃~70℃;极端嗜热菌(hyperthermophiles)的最适生长温度大于80℃。图1-10是微生物通常的温度耐受范围。
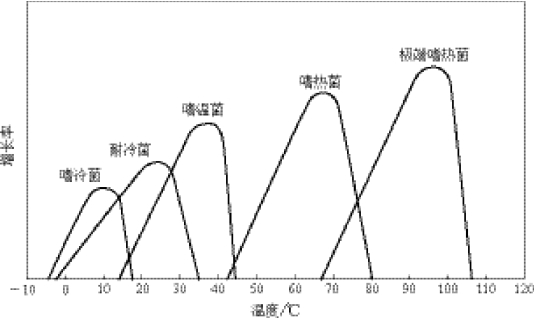
图1-10 微生物通常的温度耐受范围
在海底发生扩张运动的地方,地壳会有裂口,沿着裂口会逐渐形成热液喷口。有些喷口是“海底黑烟囱”,喷出的水柱因含有化学物质而呈现出灰色和黑色。在海底热液系统中,海水的温度超过350℃,与周围的海水形成一个温度梯度,分布着大量的极端嗜热菌。大部分的极端嗜热菌都属于古菌域,几个极端嗜热古菌的全基因组已被测序。细菌域中只有两个主要的属,即产液菌属(Aquifex)和热袍菌属(Thermotoga)是极端嗜热菌。
产液菌属如嗜火产液菌(A.pyrophilus)和风产液菌(A.aeolicus)是极端嗜热菌(最高生长温度可达95℃),而且是化能自养菌,它们在海洋热液喷口处的初级生产力中起主要作用。它们以氢气、硫代硫酸盐或元素硫为电子供体,以氧气或硝酸盐为电子受体而生长,并通过还原性柠檬酸循环这一与众不同的过程进行碳的固定。
热袍菌属如海栖热袍菌(T.maritima,图1-11)和那不勒斯热袍菌(T.neapolitana),广泛分布于地热区域并存在于浅海和深海的热液喷口处。不同菌种的最适生长温度也不同,从55℃到80℃~95℃。它们为发酵型的、厌氧的化能异养菌,能利用多种碳水化合物,也能固氮,并将元素硫还原为硫化氢。和产液菌属一样,热袍菌属在生物工程方面有相当大的应用潜力。
极端嗜热菌既有好氧菌也有厌氧菌,既有化能自养菌也有化能异养菌。这些微生物的酶和结构蛋白有很高比例的疏水区和二硫键,在蛋白质的关键部位特定的氨基酸影响了其三维结构,因而在高温条件下有很高的活性和稳定性。极端嗜热古菌的细胞膜含有醚连接的异戊二烯单元,而且具有单层膜的结构,在高温条件下更加稳定。

图1-11 海栖热袍菌(引自Prescott et al,2002)
从细胞两端延伸出疏松的鞘,标尺=1μm
4.最大的海洋细菌—费氏刺骨鱼菌(Epulopiscium fishelsoni)
费氏刺骨鱼菌(图1-12)是已知最大的细菌之一,最初发现于大堡礁(Great Barrier Reef)和红海的食草棘鱼(surgeonfish)消化道中的共生生物,因为个体较大曾被误认为是一种原生生物。费氏刺骨鱼菌的细胞可达600μm×80μm,并有特殊的细胞内结构。大量的DNA围绕着细胞周质形成核体网。细胞质中含有一些小管、液泡和囊状物,与真核原生生物中的类似,参与胞内营养物质的运输和代谢废物的排泄。其繁殖方式也非常特殊,费氏刺骨鱼菌是“胎生的”(viviparous),即新的细胞在母体细胞内形成,然后母体细胞局部裂解释放出子代细胞。尽管目前这类菌还未能培养出来,但最近16S rDNA测序结果表明,费氏刺骨鱼菌与多胞锥柱杆菌(Metabacterium polyspora)的亲缘关系最近。

图1-12 费氏刺骨鱼菌(E. fishelsoni;200×;引自Prescott et al,2002)
5.细菌的“活的非可培养状态”(viable but nonculturable,VBNC)
细菌的“活的非可培养状态”,是指细菌处于不良环境条件下的一种特殊存活形式,呈现另一种休眠的状态,用常规培养基在常规培养条件下不能使其生长繁殖,但细胞仍具有代谢活性。进入VBNC状态的细菌,其形态、生理生化、遗传机制等都发生了变化,尤其是它在本可以生长的常规培养基上失去了生长繁殖的能力,这使得它们极易在常规检测中被遗漏。但VBNC状态的细菌在适宜条件下可以恢复其正常生长繁殖的功能。
已知能诱导细菌进入VBNC状态的环境因素包括温度、射线、盐度或渗透压、寡营养条件、干燥、pH的剧烈变化等。大多数细菌进入VBNC状态后,细胞体积变小,缩成球状,对营养物质的吸收减少,核糖体及核酸物质的密度明显降低,细胞质浓缩,蛋白质和脂质总量下降,同时细菌在VBNC状态下对多种胁迫条件的抗性增强。在DNA合成抑制剂的作用下,添加一定量的营养物培养时,这些细胞虽然不能分裂,但仍可以伸长生长,证明其仍然存活,并非死亡(图1-13)。
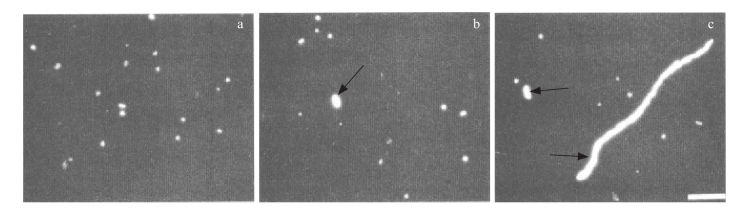
图1-13 DAPI染色的海洋细菌在荧光显微镜下的图像
a.培养前;b.萘啶酮酸培养6h;c.萘啶酮酸培养18h。标尺=10μm
当前,关于VBNC状态的细菌在自然环境中是如何复苏并恢复可培养状态的过程尚不完全清楚。直接逆转不利的环境条件可使某些VBNC状态的细菌复苏,如将培养温度恢复至最适条件、在培养基中添加某些营养盐、过氧化氢分解剂、添加渗透压保护剂抵抗盐度胁迫等。
细菌VBNC状态概念的出现,对传统的微生物生态学、食品安全、环境监测、菌种保藏以及流行病学研究等均提出了新的认识和挑战。目前检验检疫系统流行的微生物学检验主要是用常规培养法。由于细菌活的非可培养状态的存在和发现,常规培养法所得结果的可靠性应重新审查,因为常规培养法不能检测出在自然界中实际存在的、仍然具有毒力的、在特定条件下可以复苏的非可培养状态的病原菌和粪便污染指示菌。很大比重的进出口食品为冷冻食品,由于低温、干燥等物理、化学因素的影响,很多细菌可能以活的非可培养状态的形式存在。这些常规培养法检测不出来的细菌对人们的健康构成潜在的威胁,应引起检验检疫系统细菌检验人员的高度重视。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















