五、矿物键型与晶格类型
在矿物晶体结构中,各化学元素的质点之间必须通过一定的作用力而联系在一起形成稳定的格子状构造。而化学元素的质点之间的作用力被称为化学键。而化学键的形成是各种化学元素的价电子在原子核之间进行重新分配的结果。不同的化学元素,由于各自得失电子的能力有所不同,形成的化学键的种类有所不同。因而也会形成不同化学键类型的晶体,这些晶体的结构、物理性质、化学性质等方面会存在较大的差异。根据晶体中化学键的类型可将其分为不同的晶格类型,各类型的特征如下:
(一)离子晶格
在离子晶格中,结构单位主要为阳、阴离子,它们之间以静电引力相互结合,形成的化学键主要是离子键,离子的电子云一般不产生明显地变形,导致离子键无方向性和饱和性。结构中,离子之间的结合方式既取决于阴、阳离子的电价平衡,又取决于阴、阳离子的半径比值。
在离子晶格中,一般阴离子由于半径大常作最紧密或似最紧密堆积,阳离子充填于四面体或八面体空隙中,阳离子的配位数主要为4或6。为保持电性中和,阴、阳离子须按一定比例分布。
在离子晶格中,离子之间均具有一定的距离。离子间电子密度低,对光的吸收性差,光通过离子晶格比较容易,因此在光学性质上表现出折射率低,反射率小。晶体大多呈透明或半透明状。常具有玻璃光泽。一般不导电。但融化后往往导电。如石盐晶体则为典型的离子晶体。
离子晶格的热膨胀系数低。由于离子键的键性受到离子半径、离子电荷等因素影响,其晶体的稳定性、硬度、熔点等性质变化比较大。半径小,电荷高的离子间的离子键强度大,形成的离子晶体硬度大,稳定性好。否则反之。
(二)原子晶格
在原子晶格中,原子之间的化学键为共价键,即原子之间以共用电子对的形式达到稳定的电子构型并使电子云发生重叠而成键。共价键的形成数目受原子核外电子构型的控制,即取决于它的价电子中未配对的电子数,而相邻原子形成的共用电子对只能沿空间一定的方向上形成,所以共价键具有方向性和饱和性。
在原子晶格中,原子之间形成共价键的位置与数目由原子核外未成对电子数目决定,其化学键空间分布也受未成对电子的电子云方向所决定。因而晶体结构中,原子的堆积密度要比离子晶格的低,原子的配位数一般比较低,多在4以下,常见有4、3、2等。
原子晶格一般由相同的元素或电负性接近的不同元素所形成,元素间遵守定比、倍比定律。
在原子晶格中,由于共价键具有方向性,化学键之间电子云密度特低,对光的吸收性差,光通过原子晶格比较容易,导致晶体大多呈透明或半透明状,常具有玻璃—金刚光泽。由于电子均处于成对状态,一般不导电,即使融化后也不导电,为良绝缘体。例如金刚石晶体。
原子晶格的晶体由于键强大,远大于离子键键强,一般晶体的硬度、熔点比较大,其远大于离子晶体。
(三)金属晶格
在金属晶格中,金属原子之间的化学键为金属键,它的特点为价电子的“公有化”,即在金属晶格中,各个金属原子的价电子不受个别原子约束,而是作为自由电子弥漫于整个晶体结构中,把所有失去价电子的金属阳离子联结起来形成金属键。
在金属晶格中,金属原子的电离能越小,自由电子的密度则越大,原子间的结合力越强,则金属键的键强越大。金属晶格中,每个金属原子的结合力都是依球形对称分布的,即金属键无方向性和饱和性。各个金属原子则具有相同或近于相同的半径,整个结构则呈等大球体最紧密堆积规律,一般原子的配位数特高或很高,大多数为12,个别为8。
在金属晶格中,组成的金属元素的电负性差值特小,除水银(Hg)外,一般在常温下形成晶体,它们之间结合不遵守定比、倍比定律。
由于在金属晶格中出现有自由电子,所以所有金属晶体均为电和热的良导体。一般不透明,晶体反射率高,密度大,具有强金属光泽,硬度低,延展性强。
(四)分子晶格
在分子晶格中,存在着中性真实分子,分子内部的原子之间以共价键联结,分子之间则通过极弱的键力联结,而联结分子之间的化学键被称为分子键,又被称为范德华键(The Van Der Wealsbond)。分子键力可分成三种类型的作用力:
(1)取向力。为极性分子偶极间的相互吸引而产生极化形成诱导偶极距所发生的作用力。
(2)诱导力。为非极性分子在极性分子偶极距电场诱导下发生极化形成诱导偶极距而发生的作用力。
(3)色散力。为分子具有瞬间的周期变化的偶极距,伴随这一周期变化的偶极距会产生同步的电场,它导致相邻的分子被极化,相邻分子的极化可使瞬变偶极距的变化幅度增加而产生的连续作用力。
在分子晶格中,分子键没有方向性与饱和性。在结构中分子之间尽可能进行最紧密堆积,但由于分子大多数不是球形的,其堆积的方式和紧密程度比较复杂。
在分子晶格中,由于分子键的键强比较小,导致其晶体一般熔点低,可压缩性大,热膨胀率大。导热性低,硬度特小。大部分晶体不导电,透明度高,属于非金属光泽。如自然硫晶体则具有这些典型性质。
(五)氢键型晶格
氢原子由于体积小,静电场强度大,在晶体结构中可与两个电负性极大而半径较小的原子(如O、N、F等)结合而产生一种特殊的作用力,这种作用力被称为氢键。其结合方式为X—H……Y(X、Y常为O、N、F),其中“—”表示为共价键。
氢键与范德华键有些相似,但键力大于范德华键。它与范德华键有两个明显的区别:其一为饱和性,体现在X—H只能与一个Y结合;其二为方向性,体现在偶极距X—H与Y结合只有三者处于同一条直线时最强。
氢键可分为分子间氢键和分子内氢键,前者体现在一个分子X—H键与另一个分子的Y结合形成的氢键,如水分子的O—H……O的键性;后者体现在一个分子X—H键与它内部的Y结合形成的氢键,如HNO3分子中存在的O—H…O的键。
氢键型晶格主要存在于有机化合物晶体中,在矿物中只有冰等少数晶体具有。但含氢键的矿物晶体是很多的,如云母类、角闪石类矿物晶体都有氢键存在。
氢键的键力不强,但对晶体的物理、化学性质影响明显。含有分子间氢键的晶体一般熔点、沸点增高。熔化热、汽化热、表面张力、粘度增大;含有分子内氢键的晶体一般熔点、沸点降低;晶体具有低的配位数,密度低等特点。
(六)过渡键型晶格
在一些晶体结构中,离子间的化学键常处于离子键-共价键、共价键-金属键、离子键-金属键之间的过渡状态,这类化学键被称为过渡键,形成的晶体被称为过渡键型晶格。
在晶格中,离子的化学键键性则通过其离子键或共价键所占百分比来衡量,常用的度量尺度为元素的电负性(X)。电负性(X)为某一元素的原子与其他原子作用时,从其他原子接受电子的能力。两个相互作用原子的电负性差值(ΔX)则决定了电子移动的情况,也就决定了化学键的性质。其具体数据见表6-5。
如两元素的ΔX接近于4,则形成典型的离子键;两元素的ΔX接近于0,则形成典型的金属键或共价键;在ΔX=0~4之间时,当ΔX=1.7,元素的离子键和共价键各占50%;ΔX>1.7,元素以离子键为主;ΔX<1.7,元素以共价键为主。
表6-5 离子电负性差值与离子键所占比例(%)(据潘兆橹1993)
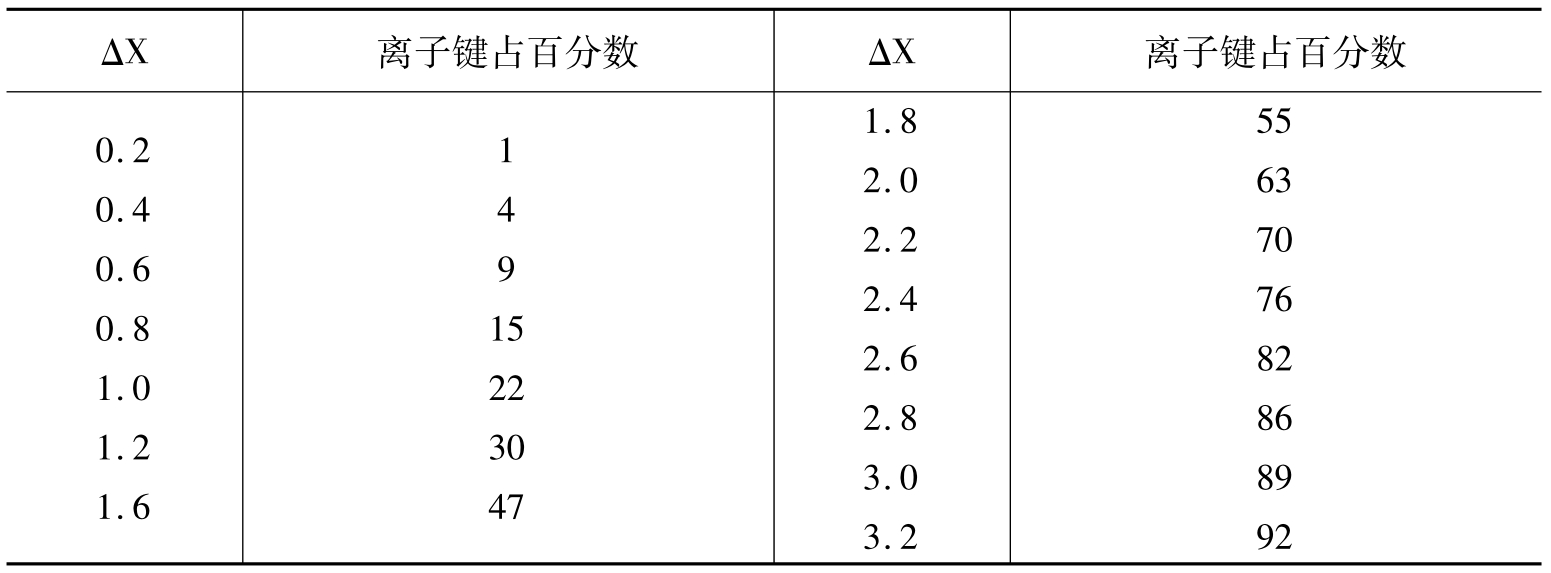
此外,在晶体结构中,原子或离子的电子云会发生变形,形成重心偏离,产生极化现象。离子极化引起离子变形,电子云穿插、重叠,导致离子键向共价键过渡。同时会引起晶体结构、晶体物理性质及化学性质发生改变。
在实际大多数晶体中,不存在单纯的、典型的一种键性,而是不同程度的各种键性之间呈过渡状态存在,其中只是以一种键性为主而已。
(七)单键与复合键及其晶格
在矿物晶格中,一些晶格中基本上由某一种单一化学键组成,这样的晶格被称为单键晶格,如金刚石晶格仅存在有碳原子形成的共价键;自然金晶格仅出现有金原子之间形成的金属键。
在许多晶格中,可以包含有两种或两种以上的化学键种类,这样的晶格被称为多键型晶格,如磷灰石Ca5[PO4]3(F,Cl,OH)晶格中,Ca2+与[PO4]3-间以离子键联结,[PO4]3-中的P-O间以共价键联结,而Ca2+与F-、Cl-、OH-间以离子键或氢键联结等表明是由多键组成的晶格。
对于多键型晶格一般依晶格中占主导地位的键性和晶体主要物理性质而将其划归为某一种典型键型晶格,如将磷灰石晶格划归为离子型晶格。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















