第三节 胶体金标记检测技术
1971年Faulk和Taytor将胶体金应用于免疫化学,此后免疫胶体金技术作为一种新的免疫学方法,在生物医学各领域得到了日益广泛的应用。Muller等(1980)应用该技术对牛痘病毒进行了免疫电镜研究,Geoghegan等(1980)和Leuvering等(1981)应用胶体金进行了被动凝集试验,Leuvering等(1983)利用胶体金做了人妊娠诊断研究,Manara等(1984)用过氧化物酶和金染色进行了细胞膜双标记的免疫电镜研究,Wybran等(1985)应用金染色对淋巴细胞亚群做了计数研究。
目前在医学检验中的应用主要是免疫层析法和快速免疫金渗滤法(DIGFA),用于检测HBsAg、HCG和抗双链DNA抗体等,具有简单、快速、准确和无污染等优点。
免疫胶体金技术的基本原理是氯金酸(HAuCl4)在还原剂作用下,可聚合成一定大小的金颗粒,形成带负电的疏水胶溶液。由于静电作用而成为稳定的胶体状态,故称胶体金。胶体金是负电荷的疏水胶,其颗粒是单个散在的,直径从几纳米到几十纳米不等,呈橘红色。在电解质中,胶体金是不稳定的,除非首先用巨分子(如蛋白质)将胶体金包被起来。用蛋白质包被胶体金,方法简便,速度快,而且重复性好。另外,由于胶体金颗粒呈橘红色,有利于肉眼观察。胶体金标记,实质上是蛋白质等高分子被吸附到胶体金颗粒表面的包被过程。吸附机理可能是胶体金颗粒表面负电荷,与蛋白质的正电荷基团因静电吸附而形成牢固结合。用还原法可以方便地从氯金酸制备各种不同粒径、也就是不同颜色的胶体金颗粒。这种球形的粒子对蛋白质有很强的吸附功能,可以与葡萄球菌A蛋白、免疫球蛋白、毒素、糖蛋白、酶、抗生素、激素、牛血清白蛋白多肽缀合物等非共价结合,因而在基础研究和临床实验中成为非常有用的工具。
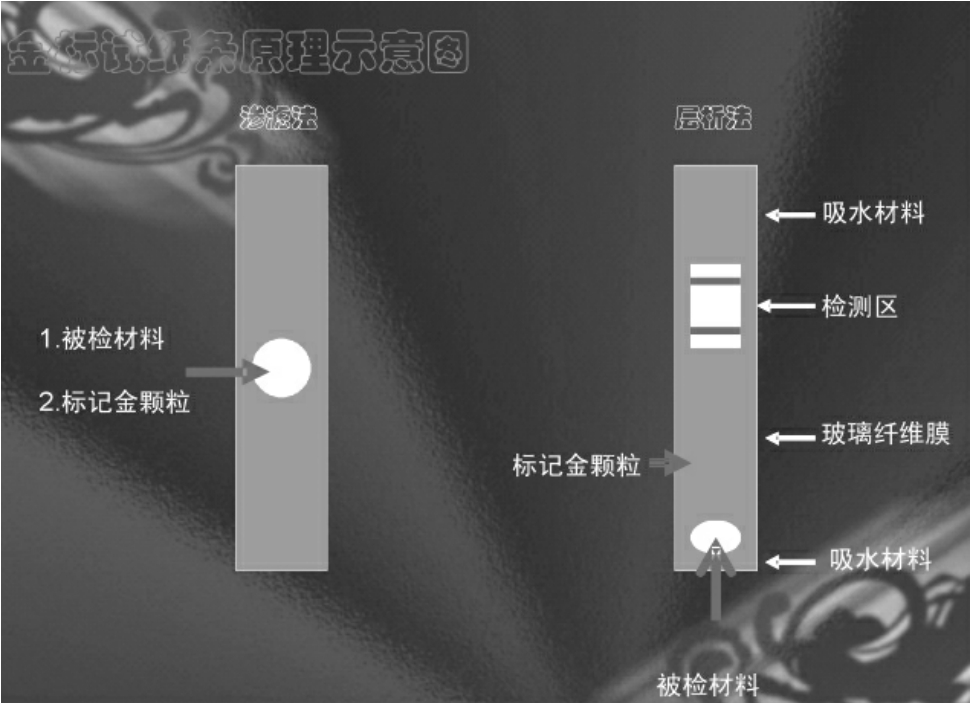
胶体金检测技术原理示意图
金标过程中,无共价键形成,是一定离子浓度下的物理吸附。因此几乎所有的大分子物质都可被金标记,标记后大分子物质活性不发生改变。实验结果表明,胶体金的敏感性可达到ELISA的水平。而结合银染色时,检测的敏感性更大大提高。胶体金具有很高的动力学稳定性,在稳定因素不受破坏时自身凝聚极慢,可放置数年不发生凝聚。影响稳定的因素主要有电解质、溶胶浓度、温度、非电解质等。
胶体金取代传统三大标记物,用于肉眼水平的免疫检测中。除了胶体金本身具有的特点外,还有以下优点:①试剂和样本用量极小,样本量可低至1~2μl;②不需γ-计数器、荧光显微镜、酶标检测仪等贵重仪器,更适于现场应用;③没有诸如放射性同位素、邻苯二胺等有害物质参与;④实验结果可以长期保存;⑤时间大大缩短,提高了检测速度。
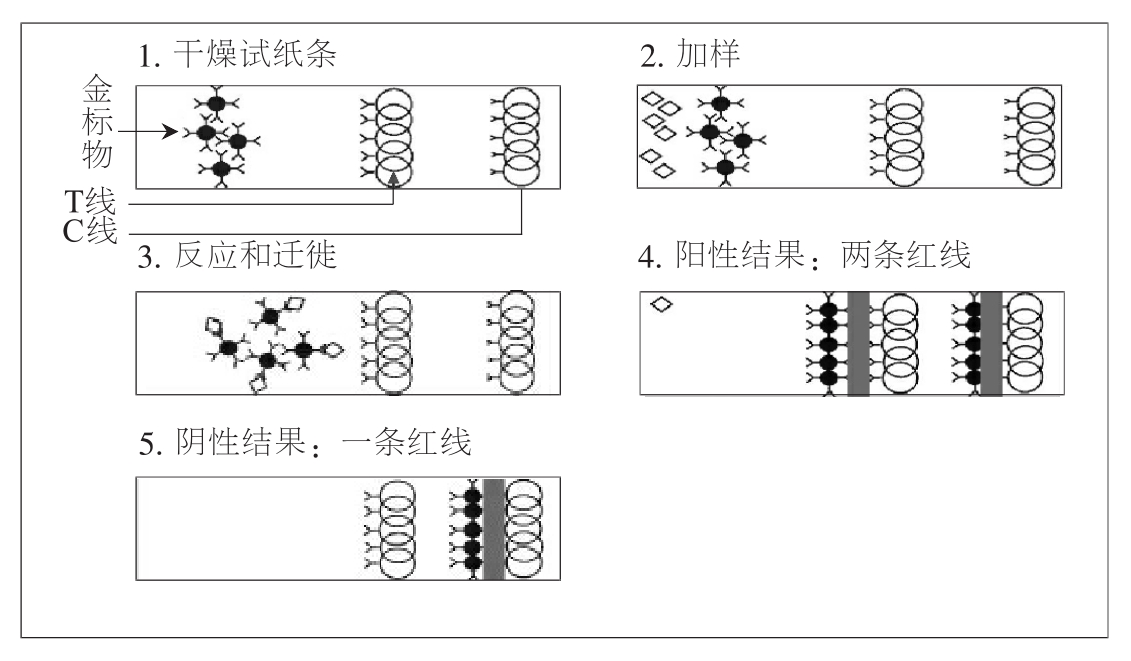
免疫层析原理图

检测抗原及抗体试纸条判断标准
免疫层析法是一种快速诊断技术,其原理是将特异的抗体先固定于硝酸纤维素膜的某一区带,当该干燥的硝酸纤维素一端浸入样品后,由于毛细管作用,样品将沿着该膜向前移动,当移动至固定有抗体的区域时,样品中相应的抗原即与该抗体发生特异性结合,若用免疫胶体金或免疫酶染色可使该区域显示一定的颜色,从而实现特异性的免疫诊断。
目前使用的试纸条有检测抗原或抗体的两种。其基本原理都是夹心法。夹心法测抗体:固定于膜上的鼠疫F1抗原+标本中的相应抗体+金标记的抗原显色。夹心法测抗原:固定于膜上的单克隆抗体+标本中待测抗原+金标记的另一株单克隆抗体显色。
操作方法也十分简单。一般的操作方法是在试纸条的上样口处滴加100~200μl样品;也可以将上样口直接插入标本中,深度10~15mm,20s,取出后平放,这种方法比较麻烦且容易造成污染而不推荐使用。
加样15min后可以判断结果。将上样口放置左侧,会看到右侧窗口内靠右的质控带显色,如果靠左处显示条带,则判为阳性,无条带为阴性。前者为检测抗体的试纸条的实验结果,后者为抗原的。
使用试纸条时必须注意保存温度,试纸条虽然可在室温保存,但大批暂时不用的试纸条还是应该放在4℃保存,以免抗体失效,从冰箱刚取出的试纸条则应待其恢复至室温,然后才打开密封,可避免反应线模糊不清。
但目前鼠疫金标—抗体检测中,目前还不能对全血样本直接检测,需在血清分离后才能检测。下一步可考虑在检测条上加滤膜首先对全血成分进行滤过,然后检测。
【注意】
在鼠疫免疫金标—抗原检测中,应尽可能将待检的可疑菌株培养在37℃的条件下、24h后再进行检测。因为体外培养条件下,鼠疫菌F1抗原的最大量合成是在37℃,而在低于28℃的条件下几乎不能合成及表达。也不能对蚤样本直接进行检测,因为在蚤体内的鼠疫菌不合成F1抗原。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















