探讨木炭还原氧化铜的最佳方案
鄂宜昌葛洲坝一中周柏洲李广萍老师找到了木炭还原氧化铜较为满意的方案,现介绍如下:
1.反应混合物的粒度和均匀度
木炭还原氧化铜实验的反应物是固体,而固体物质的反应发生在其表面,若固体颗粒越小,其表面积越大,相互的接触面越大,越利于反应的进行。
另外,固体物质混合的均匀程度对实验的成败也至关重要,均匀度越高,反应物之间相互接触的几率就越大,也就越有利于反应的进行。
2.反应物的配比选择
本实验炭与氧化铜反应的化学计量比为12∶159,以此为参考基准,选择化学纯试剂氧化铜与普通木炭进行配伍,并考虑了木炭的纯度、吸附作用及炭粉在实验过程中的损失,等因素,以mc∶mCuO=1∶10进行实验,效果最佳。
3.混合物的用量与装填方式
木炭与氧化铜的反应需要在较高的温度下才能顺利进行,试验表明,反应混合物的用量较少和平铺于试管底部,仅靠酒精灯提供的热量不足以使反应剧烈进行。其原因是:反应物用量较少,反应时放出的总热量就少,热量也容易散失,反应混合物的温度不易升高。反之,若反应物的用量适当大,并且略微密实堆积,则容易产生和聚集足够的热量,使反应混合物的温度迅速上升(可达1000℃~1100℃),反应呈炽热的燃烧状进行,反应放出的热量又将还原出来的铜熔化,凝结成颗粒或块状。
注意:在装填时,反应混合物不能将试管底封住,应留出一定空间排放气体,否则,剧烈反应产生的大量气体会把混合物冲离试管底部,也不能疏松平铺。
4.加热方式的选择
这一实验可用酒精灯或酒精喷灯作热源,但各有利弊。
本实验方案选用酒精灯加热,在酒精灯上加一个金属网罩,使火焰集中,并适当提高火焰温度。
加热时,火焰集中在反应物较多的中后部,使反应从混合物的中后部发生,向两端进行;这样,可以防止混合物被气体冲离试管底部。另外,还应注意火焰不能飘动。
反应停止后继续加热一段时间,作用在于使反应产物的温度降低至与试管一致,防止因内外温差过大引起的试管炸裂现象。
5.木炭活性对实验的影响
普通的木炭杂质含量较高,并且吸附有一定量的水蒸气和其他气体,活性较低。试验表明,放置时间长久而又不经过加热烘烤处理的木炭,效果很差。所以,在实验准备中尽量选择新烧制的木炭,而且在称量混合前还必须再做烘烤处理。
6.实验装置
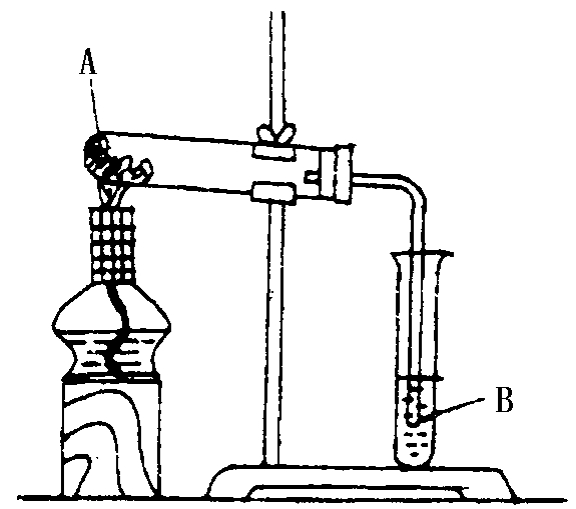
A:C+CuO B:澄清石灰水
7.实验操作
(1)炭粉与氧化铜混合
将木炭和氧化铜分别研细成粉末,直到用手搓揉感觉滑腻无明显的颗粒即可。总之,越细越好,然后将研好的炭粉和氧化铜粉在120℃下烘烤1小时以上。
烘烤后的炭粉和氧化铜粉放在干燥器里冷却。
实验时:按mc∶mCuO=1∶10快速称取经烘烤过的炭粉和氧化铜粉,放于研钵中认真研磨10分钟左右,使其充分混合,盛于试剂瓶里备用。
(2)在一干燥的试管里放入混合好的炭粉与氧化铜的混合物2.5~3克(在试管内约2cm柱高),并使混合物堆积于试管底部,略微敦实,呈斜坡状。
按图示装配好。
(3)缓慢移动酒精灯4~5次进行预热,然后,将火焰中轴线的外焰部分集中在距试管底端约1.5cm处加热;2~3分钟后反应自行剧烈发生。
反应停止后,继续加热约半分钟,取下导管,待冷却后,再把试管里的物质倒在纸上观察。
8.实验现象
加热约半分钟时,试管口有水凝结;约1分钟,澄清的石灰水开始变浑浊,继之气泡放出速度加快,石灰水很快全部变浑浊。
加热2~3分钟后,反应呈现炽热的燃烧状态,反应放出的热量维持着反应自行进行,反应物质部分熔化;同时,有大量气体放出,石灰水又由浑浊变为澄清,并有气体冲出试管的现象。
试管的中部和口部可见有黑色粉末。
反应后的固体物质凝结成颗粒或块状,可见有金属铜的紫红色光泽。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















