1.任何情况都遵循原子守恒,它是质量守恒定律微观应用,即为:
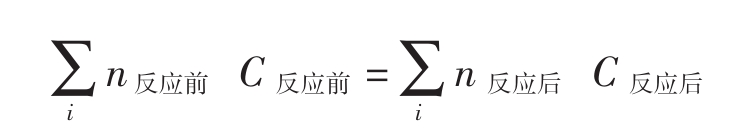
例6:工业上制硫酸的主要反应如下:

③煅烧2.5t含FeS285%的黄铁矿石(杂质不参加反应)时,FeS2中的S有5.0%损失而混入炉渣,计算可制得98%硫酸的质量。
[分析]这是一道关于工业生产的多步反应的计算题,其中涉及最初反应物FeS2,中介物质SO2、SO3,最终产物H2SO4等多种物质间的数量关系,FeS2→SO2→SO3→H2SO4。
如果我们按照反应过程,依如下流程计算:m(FeS2)→m(SO2)→m(SO3)→m(H2SO4),其过程将是相当繁杂的。那么,可以根据原子守恒法计算,即可得FeS2~2H2SO4。
解:由于有5.0%的S损失,2.5t含FeS285%的黄铁矿石中参加反应的S的质量为:
![]()
可制得98%硫酸的质量为x。

2.氧化还原反应遵循电子守恒,即为得电子数=失电子数,也可为

例7:将10.416g铁丝溶于过量的盐酸,在加热条件下用5.050g硝酸钾去氧化溶液中的Fe2+。待完全反应后,剩余的Fe2+还需要用24.0 mL 0.300 mol/L的高锰酸钾溶液才能够完全氧化(KMnO4的还原产物是Mn2+),试通过计算确定硝酸钾的还原产物,并写出硝酸钾与氯化亚铁反应的化学方程式。
解析:按题意 ,又知,在加热条件下,Fe2+能被酸性KNO3氧化,剩余的Fe2+又能被酸性KMnO4溶液氧化。故本题的还原剂是Fe2+。其氧化产物是Fe3+,氧化剂是KMnO4和KNO3,KMnO4的还原产物是Mn2+,而KNO3的还原产物正是题目要求回答的。
,又知,在加热条件下,Fe2+能被酸性KNO3氧化,剩余的Fe2+又能被酸性KMnO4溶液氧化。故本题的还原剂是Fe2+。其氧化产物是Fe3+,氧化剂是KMnO4和KNO3,KMnO4的还原产物是Mn2+,而KNO3的还原产物正是题目要求回答的。 被氧化
被氧化 失去电子的总数是:0.186mol×1=0.186mol,KMnO4被还原
失去电子的总数是:0.186mol×1=0.186mol,KMnO4被还原 得到电子的总数是:0.024L×0.3mol/L×5=0.036mol。设
得到电子的总数是:0.024L×0.3mol/L×5=0.036mol。设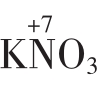 还原产物中的氮元素为x价则KNO3被还原得到的电子总数为:
还原产物中的氮元素为x价则KNO3被还原得到的电子总数为:
![]()
根据电子守恒原理得下列方程:0.036mol+0.05(5-x)mol=0.186mol
解之x=2
故KNO3的还原产物为NO,其反应方程式为:
KNO3+3FeCl2+4HCl=3FeCl3+KCl+NO↑+2H2O
3.溶液中遵循电荷守恒,即为正电荷数=负电荷数,也可为

例8:在某Al2(SO4)3和K2SO4混合溶液中,Al3+物质的量浓度为0.4mol/L,SO42-物质的量浓度0.7mol/L,则K+的物质的量浓度为多少?
分析:电荷守恒:C(K+)+3C(Al3+)=2C(SO42-)
∴C(K+)=2×0.7mol/L-3×0.4mol/L=0.2mol/L
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














