分析实验室用于溶解、稀释和配制溶液的水,都必须先经过纯化。分析要求不同,水质纯度的要求也不同。故应根据不同要求,采用不同纯化方法制备纯水。
一般实验室用的纯水有蒸馏水、二次蒸馏水、去离子水、无二氧化碳蒸馏水、无氨水等。
2.1.1 分析实验室用水的规格
根据GB 6682—1992《分析实验室用水规格及实验方法》的规定,分析实验室用水为三个级别:一级水、二级水和三级水。分析实验室用水应符合表2-1所列的规格。
表2-1 分析实验室用水的级别及主要技术指标
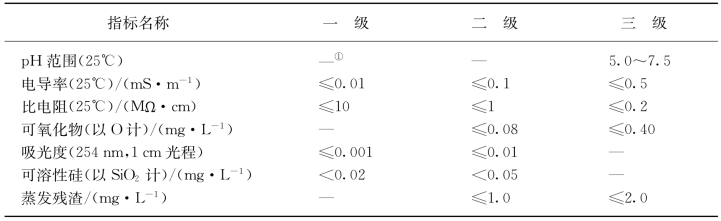
①难以测定,不做规定。
一级水用于有严格要求的分析实验,包括对微粒有要求的实验,如高效液相色谱用水。一级水可用二级水经过石英设备蒸馏或离子交换混合床处理后,再经过0.2μm微孔滤膜过滤来制取。
二级水用于无机痕量分析等实验,如原子吸收光谱分析用水。二级水可用多次蒸馏或离子交换等方法制取。
三级水用于一般的化学分析实验。三级水可用蒸馏或离子交换等方法制取。
实验室使用的蒸馏水,为了保持纯净,要随时加塞,专用虹吸管内外均应保持干净。蒸馏水瓶附近不要存放浓HCl、NH3·H2O等易挥发试剂,以防污染。通常用洗瓶取蒸馏水,用洗瓶取水时,不要取出塞子和玻管,也不要把蒸馏水瓶上的虹吸管插入洗瓶内。
通常,普通蒸馏水保存在玻璃容器中,去离子水保存在聚乙烯塑料容器中。用于痕量分析的高纯水,如二次亚沸石英蒸馏水,则需要保存在石英或聚乙烯塑料容器中。
2.1.2 水纯度的检查
按照GB 6682—1992所规定的实验方法检查蒸馏水的纯度是法定的水质检查方法。根据各实验室分析任务的要求和特点,对实验用水也经常采用如下方法进行一些项目的检查。
(1)酸度:要求水的pH为6~7。检查方法是在两支试管中各加10 mL待测的水,一管中加2滴0.1%甲基红指示剂,不显红色;另一管中加5滴0.1%溴百里酚蓝指示剂,不显蓝色,即为合格。
(2)硫酸根:取待测水2~3 mL放入试管中,加2~3滴2 mol/L盐酸酸化,再加1滴0.1%氯化钡溶液,放置1.5 h,不应有沉淀析出。
(3)氯离子:取2~3 mL待测水,加1滴6 mol/L硝酸酸化,再加1滴0.1%硝酸银溶液,不应产生浑浊。
(4)钙离子:取2~3 mL待测水,加数滴6 mol/L氨水使呈碱性,再加饱和草酸铵溶液2滴,放置12 h后,无沉淀析出。
(5)镁离子:取2~3 mL待测水,加1滴0.1%镁试剂I(对硝基苯偶氮间苯二酚)及数滴6 mol/L氢氧化钠溶液,如有淡红色出现,即有镁离子,如呈橙色则合格。
(6)铵离子:取2~3 mL待测水,加1~2滴奈氏试剂,如呈黄色则有铵离子。
(7)游离二氧化碳:取1 000 mL待测水注入锥形瓶中,加3~4滴0.1%酚酞溶液,如呈淡红色,表示无游离二氧化碳;如无色,则加0.1 mol/L氢氧化钠溶液至淡红色,1 min内不消失,即为终点,算出游离二氧化碳的量。(注:氢氧化钠溶液用量不能超过0.1 mL)
2.1.3 水纯度分析结果的表示
水纯度分析结果通常用以下几种方法表示。
(1)毫克/升(mg/L),表示每升水中含有某物质的毫克数。
(2)微克/升(μg/L),表示每升水中含有某物质的微克数。
(3)硬度,我国采用1 L水中含有10 mg氧化钙作为硬度的1度,这和德国标准一致,所以有时也称为1德国度。
2.1.4 各种纯水的制备
1.蒸馏水
将自来水在蒸馏装置中加热汽化,然后将蒸汽冷凝即可得到蒸馏水。由于杂质离子一般不挥发,所以蒸馏水中所含杂质比自来水少得多,比较纯净。但还有少量杂质。
(1)二氧化碳溶于水中生成碳酸,使蒸馏水显弱酸性。
(2)冷凝管和接受器等装置所用的材料一般是不锈钢、纯铝或玻璃等,所以可能带入金属离子。
(3)蒸馏时,少量液体呈雾状飞出而进入蒸馏水。
为了获得比较纯净的蒸馏水,可以进行重蒸馏,并在准备重蒸的蒸馏水中加入适当的试剂以抑制某些杂质的挥发。如加入甘露醇能抑制硼的挥发,加入碱性高锰酸钾可破坏有机物并防止二氧化碳蒸出。如要使用更纯净的蒸馏水,可进行第三次蒸馏或用石英蒸馏器进行再蒸馏。
2.去离子水
去离子水是使自来水或普通蒸馏水通过离子树脂交换后所得的水。制备时一般将水依次通过阳离子树脂交换柱、阴离子树脂交换柱、阴阳离子树脂混合交换柱。这样得到的水纯度比蒸馏水的纯度高,质量可达到二级或一级水指标,但对非电解质及胶体物质无效,同时会有微量的有机物从树脂中溶出。因此,根据需要可将去离子水进行重蒸馏以得到高纯水。
3.电导水
在第一套硬质玻璃(最好是石英)蒸馏器中装入蒸馏水,加入少量KMnO4晶体,经蒸馏除去水中有机物质,即得重蒸水。再将重蒸水注入第二套硬质玻璃(最好也是石英)蒸馏器中,加入少许BaSO4和KHSO4固体进行蒸馏,弃去馏头、馏后各10 mL,取中间馏分。用这种方法制得的电导水,应收集在连接碱石灰吸收管的接受器内,以防止空气中的二氧化碳溶入水中。电导水应保存在带有碱石灰吸收管的硬质玻璃瓶内,时间不能太长,一般在两周以内。
4.高纯水
高纯水系指以纯水为水源,经离子交换、膜分离(反渗透、超滤、膜过滤、电渗析)除去盐及非电解质,使纯水中的电解质几乎完全除去,又将不溶解胶体物质、有机物、细菌、SiO2等去除到最低限度。
美国进口实验室制备高纯水Milli-Q系统的进水必须是经过电击电离作用(反渗透)蒸馏或者双蒸馏等技术取得的蒸馏水。
Milli-Q系统制备的水为一级纯水,其水质优于ASTM、CAP以及NCCLS一级水的标准。
高纯水的制备步骤如下。
(1)经预处理(电击电离作用、膜电离、二次蒸馏)的水进入系统,由泵进入Q-Gard滤柱作为最初的纯化步骤。
(2)经过预滤柱的水用波长为185~254 nm的紫外灯处理,这样可以分解有机化合物和杀灭细菌。
(3)再经过充分的过滤以除掉痕量离子以及紫外灯作用下产生的氧化产物,由紫外灯处理过的水经过超滤柱,滤除胶体粒子以及相对分子质量大于5 000的有机物分子。超滤柱的滤除物会堵塞通道,需定期清洗并由管道排出。
(4)经以上3个步骤处理的水进入最后的过滤柱,它是由0.22μm的膜(MilliPak-40)组成的,用于除掉粒径大于0.22μm的微粒及细菌。
(5)A10TOC检测器取纯水样品检测痕量有机物的含量,样品在Product模式中定期获得。
5.特殊用水的制备
1)无氨水
(1)每升蒸馏水中加25 mL 5%的NaOH溶液,煮沸1 h,然后用前述方法检查铵离子。
(2)每升蒸馏水加2 mL浓硫酸,再重蒸馏,即得无氨蒸馏水。
2)无二氧化碳蒸馏水
煮沸蒸馏水,直至煮去原体积的1/4或1/5,隔离空气冷却即得。此水应贮存于连接碱石灰吸收管的瓶中,其pH应为7。
3)无氯蒸馏水
将蒸馏水在硬质玻璃蒸馏器中先煮沸,再进行蒸馏,收集中间馏出部分,即得无氯蒸馏水。
4)pH≈7的高纯水
在第一次蒸馏时,加入NaOH和KMnO4,第二次加入磷酸(除去NH3),第三次用石英蒸馏器蒸馏(除去痕量碱金属杂质)。在整个蒸馏过程中,要避免水与大气直接接触。
5)不含金属离子的纯水
在1 L蒸馏水中加2 mL浓硫酸,然后在硬质玻璃蒸馏器中蒸馏。为消除“暴沸”现象,在蒸馏瓶中放入几粒玻璃珠或几根毛细管。这样制得的纯水含有少量硫酸,可用于金属离子的测定。但对于痕量分析,这种水仍不能满足要求,需用亚沸蒸馏水。
6)不含有机物的纯水
在普通蒸馏水中加入少量碱性高锰酸钾或奈氏试剂,在硬质玻璃蒸馏器中蒸馏。电导率为0.8~1.0μS/cm。
7)不含氧的纯水
将蒸馏水在平底烧瓶中煮沸12 h,随即通过玻璃磨口导管与盛有焦性没食子酸的碱性溶液吸收瓶连接起来,冷却后使用。
8)不含酚、亚硝酸和碘的水
在蒸馏水中加入氢氧化钠,使呈碱性,再用硬质玻璃蒸馏器蒸馏,也可用活性炭制备不含酚的水。在1 L水中加入10~20 mg活性炭,充分振荡后,用二层定性滤纸过滤两次,除去活性炭。
2.1.5 蒸馏法制纯水与离子交换法制纯水的比较
1.蒸馏法
由于纯水中大部分无机盐不挥发,因此蒸馏法制得的纯水较纯净,适合一般化验室使用。当用硬质玻璃或石英蒸馏器制取重蒸水时,加入少量KMnO4碱性溶液破坏有机物,可得到电导率低于1.0~2.0μS/cm的纯水,适用于有机物分析。
2.离子交换法
用离子交换法制取的纯水叫“去离子水”或“无离子水”,其纯度高,成本比蒸馏法低,产量大,为目前各种规模化验室所采用。适用于一般分析及无机物分析。
表2-2列出了各类方法制备纯水杂质的含量。
表2-2 各类方法制备纯水杂质的含量(单位:μg·g-1)

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














