AX2型晶体
AX2型结构主要有萤石(CaF2,fluorite)型、金红石(TiO2,rutile)型和方石英(SiO2,α-cristobalite)型结构。其中CaF2为激光基质材料,在玻璃工业中常作为助熔剂和晶核剂,在水泥工业中常用作矿化剂。TiO2为集成光学棱镜材料,SiO2为光学材料和压电材料。AX2型结构中还有一种层型的CdI2和CdCl2型结构,这种材料可作固体润滑剂。AX2型晶体也具有按r+/r-选取结构类型的倾向,见表4.14。
表4.14 AX2型结构类型与r+/r-的关系

1.萤石(CaF2)型
萤石属立方晶系Fm3m空间群,其结构如图4.18(a)所示,Ca2+位于立方晶胞的各个角顶及面的中心,形成面心立方结构,而F-则填充在八个小立方体的中心。Ca2+的配位数是8,形成立方配位多面体[CaF8]。F-的配位数是4,形成[FCa4]四面体,F-占据Ca2+离子堆积形成的所有四面体空隙。也可以认为F-作简单立方堆积,Ca2+占据立方体空隙的一半。晶胞分子数为4,由一套Ca2+离子的面心立方格子和2套F-离子的面心立方格子相互穿插而成,见图4.18(b);而每个F-周围有四个Ca2+,形成四面体结构,如图4.18(c)所示。
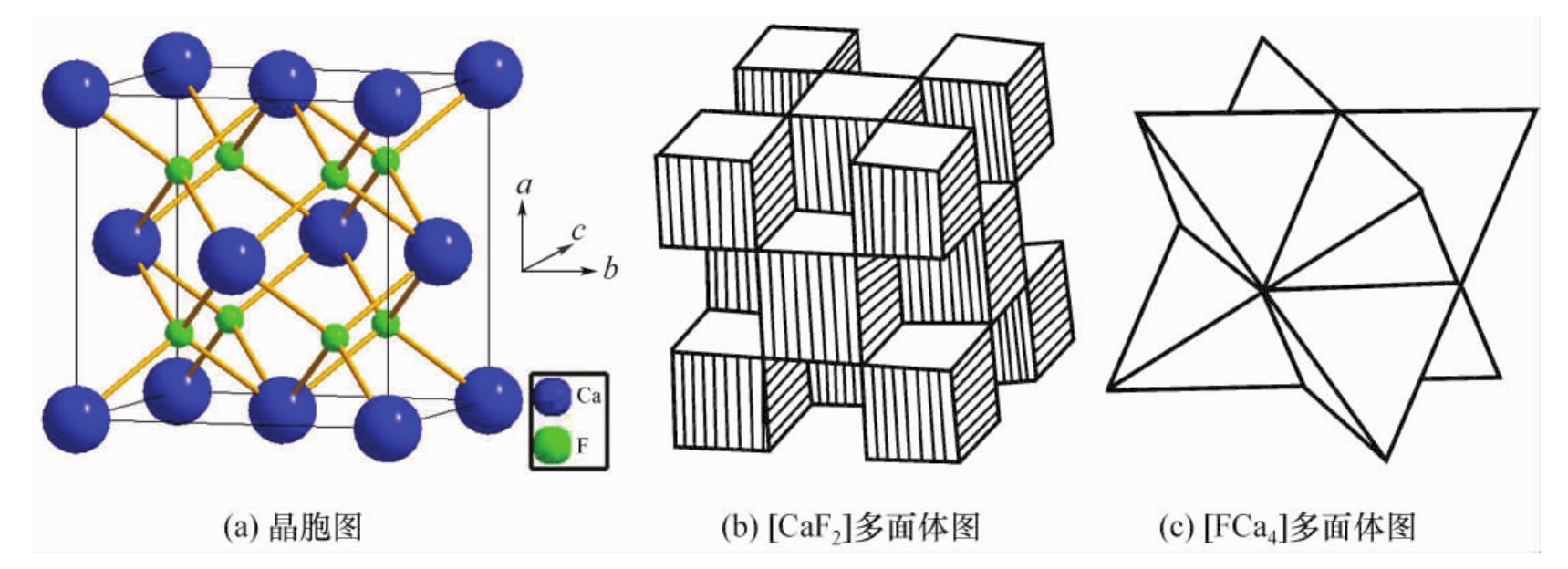
图4.18 萤石型(CaF2)型的结构
萤石在玻璃工业中一般用作助熔剂,也有用作晶核剂的。在水泥工业中则用作矿化剂。
因为Ca2+为2价,F-半径比Cl-的小,虽然Ca2+半径比Na+稍大,但总的来说,萤石中质点之间的键力应该比NaCl中的强些。反映在其性质上,萤石的硬度为莫氏4级,熔点达1410℃,在水中溶解度为0.002g。另外,由于在{111}面网方向上存在着相互毗邻的同号离子层,因而静电斥力将起主要作用,结果导致晶体平行于{111}方向发生解理,故萤石常呈八面体解理。
萤石型结构是相当于A4O2型氧化物所具有的结构,A4+和O2-分别占据Ca2+和F-的位置即是。如ThO2,CeO2及UO2等氧化物,ZrO2也属于这种结构,但变形较大。
碱金属氧化物Li2 O,Na2 O,K2 O和Rb2 O的结构属于反萤石型,它们的正离子和负离子的位置与上述情形完全相反,即碱金属离子占有F-的位置而O2-占有Ca2+的位置。这种正、负离子位置颠倒的结构,叫做反同形体。
2.金红石(TiO2)型
金红石属四方晶系P4/mnm空间群,根据A. Rubio-Ponce和A. Conde-Gallardo的研究,得知其晶胞参数为a= b=4.601nm,c= 2.977nm,α=β=γ=90°,其结构如图4.19所示,Ti4+在晶胞的顶角和中心的位置上,实际上Ti4+在晶体中是按四方简单格子排列的,晶胞中心的Ti4+属于另一套简单格子所有。由图可以看出,Ti4+的配位数是6,在它周围的6个O2-构成了八面体;另一方面,O2-则是由位于三角形顶点上的三个Ti4+包围起来,每个O2-同时为三个钛氧八面体所共有。整个结构可以看出是由O2-形成的稍有变形的六方最紧密堆积,Ti4+只填充了八面体空隙的半数。
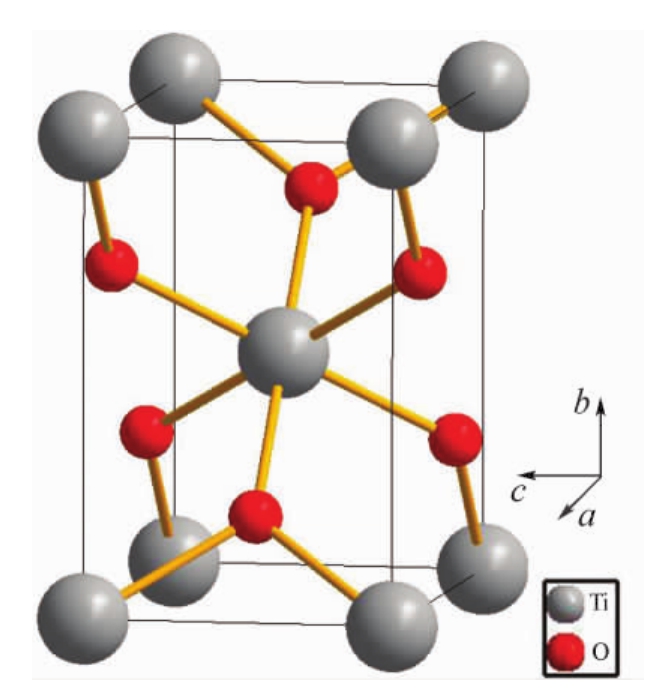
图4.19 金红石(TiO2)型的结构
TiO2除金红石之外,还存在有板钛矿和锐钛矿两种变体,结构均不相同。
TiO2在光学性质上具有高折射率(2.76),表现在电学性质上则有高的介电系数。因此,TiO2成为制备高折射率玻璃的原料,也是无线电陶瓷中需要的晶相。
SnO2,MnO2,GeO2,PbO2,VO2,NbO2等AX2型氧化物都具有金红石的结构型式。
3.碘化镉(CdI2)型结构
碘化镉属三方晶系P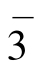 m空间群,是具有层状结构的晶体,根据B.Palosz和E.Salje的研究,得知其晶胞参数为a= b= 2.445nm,c= 6.8246nm,α=β= 90°,γ= 120°,结构如图4.20所示。Cd2+位于六方柱大晶胞的各个角顶和底心的位置上,I-则位于Cd2+三角形重心的上方或下方。每个Cd2+处在由六个I-组成的八面体中央,三个I-在上,三个I-在下。每个I-与三个在同一边的Cd2+相连。I-在结构中按(变形的)六方最紧密堆积排列,而Cd2+则相间成层地填充于半数的八面体空隙中,从而构成了平行于(0001)的层型结构。每层含两片I-,一片Cd2+。以配位多面体表示的这种层,示于图4.21。由于极化作用,层内的质点之间已有明显的共价键性质,而层与层之间则是通过分子间力来联系,所以每层内自己联系很紧,但层与层之间的力却很弱。因而晶体具有平行(0001)的完全解理。
m空间群,是具有层状结构的晶体,根据B.Palosz和E.Salje的研究,得知其晶胞参数为a= b= 2.445nm,c= 6.8246nm,α=β= 90°,γ= 120°,结构如图4.20所示。Cd2+位于六方柱大晶胞的各个角顶和底心的位置上,I-则位于Cd2+三角形重心的上方或下方。每个Cd2+处在由六个I-组成的八面体中央,三个I-在上,三个I-在下。每个I-与三个在同一边的Cd2+相连。I-在结构中按(变形的)六方最紧密堆积排列,而Cd2+则相间成层地填充于半数的八面体空隙中,从而构成了平行于(0001)的层型结构。每层含两片I-,一片Cd2+。以配位多面体表示的这种层,示于图4.21。由于极化作用,层内的质点之间已有明显的共价键性质,而层与层之间则是通过分子间力来联系,所以每层内自己联系很紧,但层与层之间的力却很弱。因而晶体具有平行(0001)的完全解理。
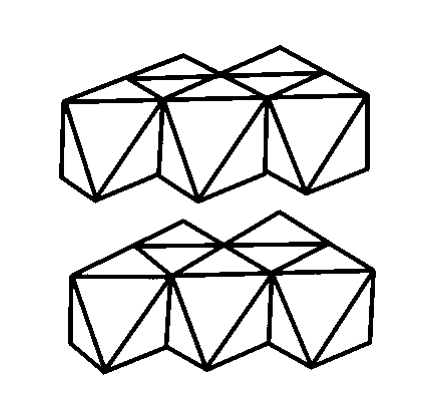
图4.20 碘化镉层状结构的晶体
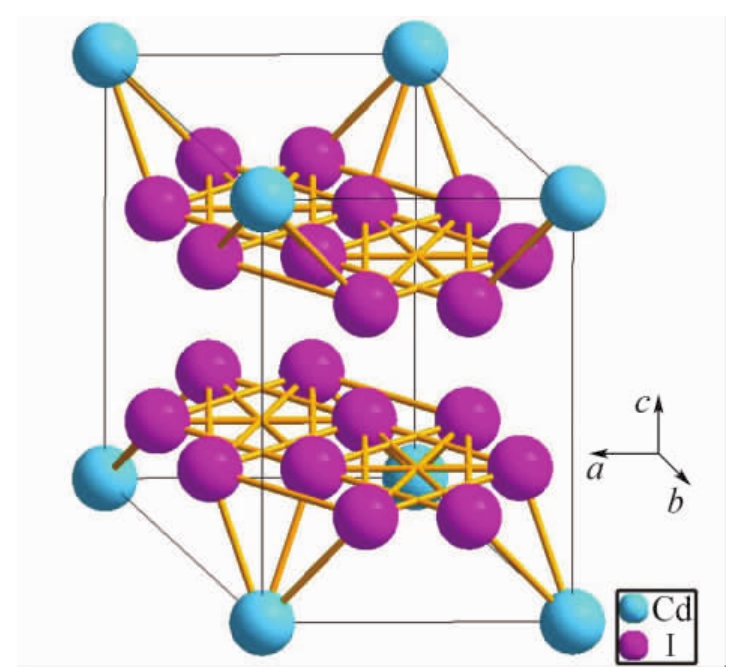
图4.21 碘化镉(CdI2)型的结构
Mg(OH)2和Ca(OH)2都是具有CdI2型结构的层状晶体。只需将Mg2+和Ca2+代替Cd2+,OH-代替I-即可。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















