10.3.2 分子轨道理论
现代染料发色理论是从物质内部能级跃迁所需能量这种微观结构来研究有机化合物颜色和分子结构的关系。
例如,在乙烯分子中,两个碳原子的Pz原子轨道,组成了两个分子轨道。一个分子轨道的能量较低,称为成键分子轨道;另一个分子轨道的能量较高,称为反成键分子轨道。在基态分子中,两个自旋相反的电子占据成键分子轨道,此时反成键分子轨道π*则为空轨道,这就是能量较低的稳定的乙烯基态分子的构型。当乙烯分子吸收光能后,在成键分子轨道π中一个电子就跃迁至反成键分子轨道,所以乙烯分子选择性地吸收一定波长的光线。见图10-1。

图10-1 乙烯分子形成示意图
若E1为分子成键轨道π的能量,E2为反成键轨道π*的能量,当一个电子从π跃迁到π*时,吸收光线的波长λmax应为:
![]()
若对结构比较复杂的分子来说,则E1代表最高充满轨道(HOMO)的能量,而E2代表最低空轨道(LVMO)的能量。它们均可以由分子轨道理论计算出来。图10-2代表不同多烯烃的能级图。显然,能级差E2-E1越小,则λmax越大,颜色越深,亦即共轭链越长,分子最大吸收波长越向长波长方向移动。当乙烯分子中引入一个具有共享孤对电子的取代基A后,取代基A上的未共享电子会对乙烯的成键轨道及反成键轨道的能级有影响。

图10-2 多烯烃的能级图

图10-3 取代乙烯能级图
由图10-3可知:取代基A的共轭效应,使取代乙烯的吸收波长向长波方向移动。对于像羰基化合物具有非键轨道的物质来说,其能级图如图10-4所示。
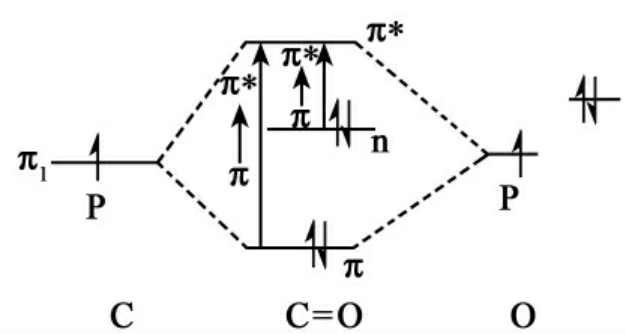
图10-4 羰基的能级图
氧原子的一对未共享电子占据在n轨道或非键轨道上,其能量较P原子轨道组成的成键分子轨道能级高,但较反成键分子轨道能级低。因此,n→π*跃迁比π→π*跃迁所需能量低,亦即羰基化合物在长波段处还有光谱吸收。一般来说,在大部分有机物中,各种电子由于吸收光子而跃迁到反成键轨道时,其最大吸收波长λmax及相应的能量ΔE的大致情况列于表10-2。
表10-2 各种电子跃迁时所需λmax及ΔE

从上表来看σ→σ*和π→π*的跃迁吸收的波长都在远紫外光部分,只有n→π*的跃迁是在近紫外光的范围内,可用通用的紫外分光光度计测出。但是若有多个双键处于共轭状态时,则n→π*跃迁所需能量便大为降低(见图10-2),而使其最大的吸收波长出现在近紫外区。所以一般说来,由σ键形成的有机化合物为无色,而含有π键的有机物有可能是有颜色的。以上所述即为分子轨道理论对染料颜色的说明,需要指出的是,该理论也只能是近似地说明物质的颜色,不能确定某一物质一定呈现何种颜色,因为理论上在处理微观分子时是近似的。
除了上述两种主要的染料发色理论之外,比较重要的还有醌型学说(1888年)和成盐学说(1915年)。前者的主要内容是:只要能生成醌型结构就是有颜色的。这可用于解释芳甲烷类、醌亚胺染料的颜色。而后者的主要内容是:染料在可见光作用下,使分子极化为内盐而产生颜色。这些学说只是程度不同地指出了部分的规律性,与实际情况出入很大,使用范围有限,故不详细介绍。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















