1.2.2 稀溶液的依数性
溶液是两种以上的物质所形成的均匀、稳定的混合物,它是化学组成和物理性质都相同的均相系统,按照溶质与溶剂的状态可分为3种类型:①气态物质与液态物质形成的溶液。②固态物质与液态物质形成的溶液。③液态物质与液态物质形成的溶液。一般情况下,将含量多的组分称为溶剂,含量少的组分称为溶质。
1.溶液浓度的表示方法 一定量的溶液里所含溶质的量,叫做溶液的浓度。它是表达溶液中溶质跟溶剂相对存在量的数量标记。因此,根据使用标准的不同,同一种溶液,其浓度有不同的表示方法。
(1)质量摩尔浓度(bB):溶质B的质量摩尔浓度(bB)用溶液中溶质B的物质的量除以溶剂A的质量来表示。它在SI单位中表示为摩尔每千克(mol·kg-1)。
式中的mA为溶剂的质量(kg),nB为溶质的物质的量(mol)。
例1.6 计算5.85gNaCl溶于72.0g水所配制成溶液的质量摩尔浓度为多少?
解:首先计算出溶质NaCl的物质的量:
NaCl的摩尔质量 M=58.5g·mol-1
NaCl溶液的质量摩尔浓度用bNaCl表示
(2)物质的量浓度(cB):溶液中所含溶质B的物质的量除以溶液的体积,称为B的物质的量浓度,可简称为浓度,用符号cB表示。其单位为mol·dm-3,也可用mol·L-1。
(3)质量分数(w,m/m):B质量与混合物的质量之比称为B物质的质量分数。质量分数用符号w表示:
(4)摩尔分数(x):溶液中溶质的物质的量n质与溶液的总物质的量n液之比,叫做溶质的摩尔分数,用符号x质表示。
体积比浓度只在对浓度要求不太精确时使用。体积比浓度属于非法定单位,将被法定计量单位体积分数代替。
2.难挥发非电解质稀溶液的依数性(colligative property)
(1)拉乌尔定律(Raoult’slaw):当难挥发的非电解质溶入溶剂形成溶液后,溶液表面有部分被溶质分子所占据,因此,溶液表面在单位时间内蒸发的溶剂分子数目小于纯溶剂蒸发的分子数目。当单位时间内凝聚的分子数目与蒸发的分子数目相等时,溶液蒸气的密度及压强要小于纯溶剂的蒸气的密度及压强。也就是说,溶液的饱和蒸气压p小于纯溶剂的蒸气压p*。
1886年拉乌尔根据实验得出难挥发的非电解质稀溶液中的蒸气压p与稀溶液中溶剂A的摩尔分数xA间的关系为:
p=p*xA (1.20)
式中的p*为纯溶剂在同样温度下的饱和蒸气压。式(1.20)说明:稀溶液中溶剂的蒸气压等于同温度下纯溶剂的蒸气压与溶液中溶剂的摩尔分数的乘积,这就是拉乌尔定律。
若xB表示溶质的摩尔分数,则xA+xB=1,将xA=1-xB代入式(1.20)得
p=p*(1-xB)
即 p=p*-p*xB
p*-p=p*xB
Δp=p*xB
式中的Δp表示稀溶液饱和蒸气压的降低值。所以拉乌尔定律也可以这样描述:难挥发非电解质稀溶液的饱和蒸气压降低值和溶质的摩尔分数成正比。
(2)溶液的凝固点降低和沸点升高:物质的凝固点(freezing point)是指在一定外压时其液相和固相平衡时的温度,这时固相的蒸气压与液相的蒸气压相等。如在100kPa外压时,纯水和冰在0℃时的蒸气压均为0.611kPa,0℃即为水的凝固点。而溶液的凝固点通常是指溶液中纯固态溶剂开始析出时的温度,对于水溶液而言,就是指水开始变成冰析出时的温度。
图1.3中,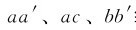 线分别表示水、冰和溶液的蒸气压与温度的关系,在三相点a(0.01℃,0.611kPa),纯水和冰的蒸气压相等,0.01℃即为纯水的凝固点。水溶液中加入溶质后,蒸气压降低,溶液蒸气压曲线与冰的蒸气压曲线相交于b点,这是溶液的凝固点。显然,溶液的凝固点比纯溶剂的凝固点下降了。实验证明,在稀溶液中,凝固点下降值(ΔTf)为:
线分别表示水、冰和溶液的蒸气压与温度的关系,在三相点a(0.01℃,0.611kPa),纯水和冰的蒸气压相等,0.01℃即为纯水的凝固点。水溶液中加入溶质后,蒸气压降低,溶液蒸气压曲线与冰的蒸气压曲线相交于b点,这是溶液的凝固点。显然,溶液的凝固点比纯溶剂的凝固点下降了。实验证明,在稀溶液中,凝固点下降值(ΔTf)为:
式中的ΔTf表示溶液的凝固点下降值,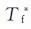 、Tf分别表示纯溶剂和溶液的凝固点;bB是溶质的质量摩尔浓度;Kf为凝固点下降常数它取决于纯溶剂的特性而与溶质特性无关。
、Tf分别表示纯溶剂和溶液的凝固点;bB是溶质的质量摩尔浓度;Kf为凝固点下降常数它取决于纯溶剂的特性而与溶质特性无关。
如在汽车、坦克的水箱(散热器)中常加入防冻剂乙二醇、酒精、甘油等,在建筑和道路用水泥砂浆中加入食盐或氯化钙等,都是为了防止冬季冰冻现象产生危害。
溶液的蒸气压与外界压力相等时的温度称为溶液的沸点(boiling point)。正常沸点指外压为101.3kPa时溶液的沸点,如在101.3kPa下水的沸点为100℃。而在稀溶液中,由于加入难挥发性溶质,致使溶液的蒸气压下降,沸点升高。
表1.2 一些溶剂的凝固点下降常数和沸点升高常数
(3)渗透压:在U形管中央置一半透膜,将高度相等的纯水和盐水隔置在半透膜的两侧(图1.4),放置一段时间,会发现盐水的液面升高,而纯水的液面降低。这种溶剂透过半透膜进入溶液的现象,称为渗透现象。
渗透必须通过一种膜来进行,这种膜上的微孔只允许溶剂分子通过,而不允许溶质的分子通过,因此叫半透膜。渗透现象发生以后,溶剂分子在单位时间内进入溶液内的数目要比溶液内的溶剂分子在同一时间进入纯溶剂的数目多,所以溶液中液面逐渐升高。当液面升高到一定程度时,半透膜两边的渗透达到平衡,这时两边液柱的高度不再变化,两边的液面高度差造成的静压称为溶液的渗透压(osmotic pressure)。渗透压是为维持被半透膜所隔开的溶液与纯溶剂之间的渗透平衡而需要的额外压力。
1887年,荷兰物理化学家范特霍夫(J.H.Van’t Hoff)提出,难挥发的非电解质稀溶液的渗透压与溶液的浓度及热力学温度成正比。
式中的Π表示渗透压,kPa;c表示溶液的物质的量浓度,mol·L-1;T表示热力学温度,K;n表示溶质的物质的量,mol;V表示溶液的体积,L;R为摩尔气体常数,kPa·L·mol-1·K-1。
渗透压在生物学中具有重要意义,它是引起水在生物体中运动的重要推动力。按式(1.23)计算,298.15K,0.1mol·L-1溶液的渗透压为248kPa,这个数值相当可观。一般植物细胞汁的渗透压约可达到2000kPa,水分可以从植物的根部运送到数十米高的顶端。人体血液平均的渗透压约为780kPa,为保持人体渗透压在正常范围,对人体注射或静脉输液时,临床常用质量分数为5.0%的葡萄糖溶液或含0.9%NaCl的生理盐水,否则会导致溶血等严重后果。
如果在溶液的一侧施加一个大于渗透压的外压力,则溶剂由溶液一侧通过半透膜向纯溶剂或低浓度方向渗透,这种现象称为反渗透现象(reverse osmosis)。它为海水淡化和环境保护中的废水处理提供了一种重要方法。
例1.7 测得30℃时葡萄糖水溶液的渗透压为252.0kPa,试求:
(1)溶液中葡萄糖的质量摩尔浓度b;
(2)沸点升高ΔTb;
(3)凝固点下降ΔTf。
解:(1)根据cRT得
稀溶液中溶液的体积近似等于水的体积,水的密度近似为1kg·L-1,所以c≈b,溶液中葡萄糖的质量摩尔浓度为0.100mol·L-1。
(2)查表1.2知水的Kb=0.51K·kg·mol-1
∴ΔTb=Kb·b=0.51×0.100=0.051(K)
(3)查表1.2知水的Kf=1.86K·kg·mol-1
∴ΔTf=Kf·b=1.86×0.100=0.186(K)
综上所述,蒸气压降低、凝固点下降、沸点升高和渗透压是溶液的基本性质。在稀溶液中它们都可定量计算,其数值只取决于一定量溶剂中实际存在的溶质个数而与具体种类无关,称为稀溶液的依数性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















