20世纪初,量子化理论的提出,对原子结构的认识是个飞跃。1900年,德国物理学家普朗克(M.Planck)根据实验提出了量子化理论:【物质辐射能的吸收或发射是不连续的,是以最小能量单位量子的整数倍作跳跃式的增或减,这种过程叫做能量的量子化】。量子的能量E和频率ν的关系是:
E=hν
式中,h为普朗克常数,h=6.626×10—34·J·s。
1905年,爱因斯坦(A.Einstein)在普朗克量子力学的基础上,提出了光子学说:光由光子组成,光的吸收或发射也不是连续的,只能以光能的最小单位光子的整数倍进行。
原子核外电子的能量具有量子化特性,它的研究首先是从氢原子光谱开始的。
(一)氢原子光谱
将白光(太阳光)通过棱镜,就能观察到红、橙、黄、绿、青、蓝、紫的光谱,其颜色逐渐过渡,就像雨后天空中出现的彩虹一样,这样的光谱叫连续光谱。
【原子光谱都是具有自己特征的不连续光谱,即线状光谱,具有量子化特性】。原子光谱中,最简单的光谱是氢原子线状光谱(图1-1、图1-2)。
图1-1 氢原子光谱的产生示意图

图1-2 氢原子结构能级示意图
在氢原子光谱中,可见光区内有五根明显的主要谱线,分别为Hα、Hβ、Hγ、Hδ、Hε,叫做氢原子的特征线状光谱。可以看出,从Hα到Hε谱线间的距离越来越短,其频率具有一定的规律性。氢原子光谱证明了:【原子中电子运动的能量是不连续的,具有量子化特性】。
1913年瑞典物理学家里德堡(Rydberg)通过测定氢原子光谱后提出计算氢原子光谱谱线频率的公式:
式中,ν为谱线频率(S—1),R为里德堡常数,R=3.289×1015S—1,n1=2,n2为>2的正整数。
为了解释氢原子光谱的规律性,1913年,年轻的丹麦物理学家玻尔(N.Bohr),在普朗克量子论、爱因斯坦光子学说和卢瑟福“天体行星模型”的基础上,大胆地提出了原子结构的假设,成功地解释了氢原子线状光谱产生的原因和规律性,从而建立了玻尔原子模型。
(二)玻尔原子模型
玻尔原子结构的假设可归结为以下三点:
1.核外电子在固定轨道上运动,具有确定的半径和能量。
在原子中,电子绕核运动的轨迹不是任意的,而是在具有确定的半径、有一定能量的固定轨道(orbit)上运动,且不放出能量也不吸收能量。
2.固定轨道必须符合量子化条件。
原子中电子绕核运动的固定轨道必须符合量子化条件,即n=1,2,3,4…的正整数,n称为量子数(quantum number)。符合量子化条件的固定轨道称为稳定轨道,其能量关系应符合:
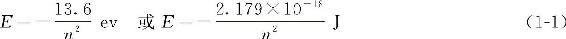
式(1-1)中,2.179×l0—18J为Rydberg常量,借助氢原子能量关系式可定出氢原子各能级的能量:
当 n=1 则E1=—2.179×10—18J
n=2 则E2=—5.45×10—19J
n=3 则E3=—2.42×10—19J
n=4 则E4=—1.36×10—19J
…… ……n越大,则电子在离核越远的轨道上运动,其能量也越大。电子运动所处的不连续能量状态称为能级(energy level)。当n→∞时,则电子将脱离原子核的电场引力,能量E→0。
3.电子处于激发态时不稳定,可跃迁到离核较近能级较低的轨道上,会放出能量。
原子中的电子尽可能处在离核最近的稳定轨道上,这时原子能量最低。能量最低的稳定轨道,称为基态(ground state)。氢原子处于基态时,电子在n=1的轨道上运动,其能量最低,为2.179×10—18J(或13.6ev),其半径为52.9pm,称为玻尔半径,用符号“a0”表示。
当原子从外界获得能量时,电子被激发到离核较远的高能级(E2)的轨道上去,此时电子处于激发态(excited state),处于激发态的电子不稳定,会跃迁到离核较近的低能级(E1)轨道上,这时就会以光子形式放出能量,高、低能级的两轨道能量差和释放出的光子频率符合下列公式:

式中,h为普朗克常数,c=2.998×108m·s—1。应用里德堡公式或玻尔假设所提出的原子模型和式(1-2)、式(1-3)可以解释氢原子光谱产生的原因。
例如:当电子分别从n=3、4、5、6、7较高能级的轨道跃迁到n=2较低能级的轨道时,分别计算出它们在可见光区的波长,为:656.3nm、486.1nm、434.1nm、410.2nm、397.0nm,依次观察到红色Hα、蓝绿色Hβ、蓝色Hγ、紫色Hδ、紫色Hε五根谱线,即Balmer线系。如图1-2所示。当电子从其他能级轨道跃迁到n=1能级轨道时,因波长短,得到紫外光区的谱线。当电子从其他较高能级跃迁到n≥3能级轨道时,因波长长,得到红外光区的谱线,其计算值与光谱实验测得的值非常吻合。
其他类氢离子(即单电子离子,如He+、Li2+、Be3+等)的光谱均可用玻尔原子模型加以解释。
玻尔原子模型理论成功之处可归结为以下几点:①说明了激发态原子发光的原因,能级间跃迁的频率条件。②较好地解释了氢原子光谱和类氢离子光谱的规律性。③首次提出电子运动状态具有不连续性、稳定轨道能级的量子化特性,提出量子数n重要概念。
玻尔原子模型理论的缺陷之处是:用经典力学推出电子有固定轨道限制了电子的运动;不能解释氢原子光谱的精细结构,如每一根谱线实际上是由几条更精细的谱线组成。也不能解释多电子原子、分子或固体的光谱,如谱线的强度、宽度、偏振等。缺陷原因是把只适用于宏观世界的牛顿经典力学搬进了微观世界,没有完全摆脱卢瑟福的“天体行星模型”的束缚,这种电子在固定轨道上绕核运动的观点是和实验事实相违背的,它没有反映电子运动的另一重要特性,即波粒二象性。
尽管玻尔原子模型理论有不足之处,但它为运用光谱现象研究原子内部结构提供了理论基础,使原子结构理论的发展进入了一个新的阶段。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















