(一)实验动物的选择
纯系小鼠作为与遗传有关的耳聋模式动物具有其他动物所无法比拟的优点。小鼠是最早被应用于进化、发育、疾病等方面遗传学研究的动物模型。除了人类之外,小鼠的基因组是目前哺乳动物中基因背景资料最完整的。由于人和鼠的听觉系统相似,小鼠的基因与人类的很多基因有比较高的同源性,能引起小鼠耳聋的基因可能在人类中也存在类似的基因,因此对于鼠系中存在的耳聋相关基因研究为我们了解人类耳聋的病因机制提供了参考,很多人类耳聋相关基因突变就是先在以纯系小鼠的耳聋相关基因突变为线索而发现的。近交系小鼠具有基因位点的纯合性、遗传组成的同源性、表型一致性、长期遗传稳定性、遗传特征可分辨性、分布的广泛性、背景资料完整性等特点,这些是纯系小鼠作为基因治疗研究模式动物的最大优点。在感音神经性耳聋基因治疗的活体实验中,能否在避免严重副损伤的前提下快速到达导入位置而又能获得良好的视野是一个关键问题,它在很大程度上决定了动物模型的选择。豚鼠和沙鼠(gerbil)由于具有较大的听泡和耳蜗在内耳研究中得到广泛应用,大鼠相对较少。小鼠由于听泡和耳蜗小、手术中不易操作、镫骨动脉又紧贴圆窗龛下方并穿过镫骨两脚之间,容易发生难以控制的动脉出血而应用较少。如何安全、高效地将目的基因转导至小鼠耳蜗内成为一个难题。
(二)基因导入途径选择的解剖基础
由于耳蜗结构特殊、精细和一直缺乏有效的靶基因用于听神经细胞的损伤和获得性及遗传性听觉疾病的治疗,基因治疗在耳科起步较晚。1996年,Lalwani等进行了遗传物质直接进入外周听系的可行性研究,从而开始了对感音神经性耳聋基因治疗的探索。
在Corti器中存在3个间隙:螺旋器隧道、Nuel间隙和外隧道,充于其中的液体称corti淋巴(corti lymph)。corti淋巴成分与外淋巴相似,通过缰孔及骨螺旋板中的小孔与鼓阶中的外淋巴相通。毛细胞顶部表皮板与内淋巴接触,其他部分浸浴在corti淋巴中并由其供应营养。这种结构构成了经鼓阶外淋巴导入外源基因在Corti器上得以表达的解剖学基础。内淋巴成分较接近于细胞内液:Na+150mmol/L、K+1~2mmol/L、葡萄糖15.2mmol/L;外淋巴成分较接近于细胞外液:Na+5mmol/L、K+145mg/L、葡萄糖76mg/L。如静息条件下以外淋巴内电位为参考电位(0mV),内淋巴电位为+80mV,毛细胞内的电位为-40~70mV。为了隔离如此高的离子梯度和绝缘这个电位差。毛细胞顶部和支持细胞靠紧密连接、桥粒连接和扩大的电性缝隙连接形成网状膜。网状膜创造了高度的对离子不可通透的屏障。由此可以推测,如果是相同的载体,经鼓阶外淋巴导入到Corti器上表达的效果不应弱于经中阶内淋巴导入。内耳基因治疗时,外源基因导入后最理想的表达位置是Corti器,所以比较适合应用经鼓阶导入。
(三)基因导入途径和方法
出于实验和未来应用于人类治疗的目的,有必要发展一种能保存听力和耳蜗结构的载体导入途径。全身应用治疗剂会带来全身毒性。直接将载体导入耳蜗有许多好处:可以用较少载体物质在导入靶器官形成较高载体浓度,增加了载体通过微渗透到达非注射部位的可能性。从内耳的解剖特点看,由于耳蜗骨壳和血迷路屏障的存在,使耳蜗成为一个相对独立的器官,为内耳基因治疗提供了理想的环境。由于耳蜗相对独立,使病毒或非病毒载体携带的基因不易进入其他组织,从而最大限度地降低全身性的免疫反应。内耳中的内、外淋巴液使载体携带的基因很容易转染到耳蜗内的细胞,从而保证了基因治疗的针对性。
目前内耳基因导入途径主要有:耳蜗打孔直接注射,耳蜗打孔离子泵导入,圆窗膜注射,半规管内淋巴囊注射,鼓阶内注射,完整圆窗膜吸收性明胶海绵法以及中阶注射等导入途径(见书末彩图28-5)。在每一导入途径中都采用不同的导入方法,包括经圆窗鼓阶显微注射或微渗透泵导入;耳蜗切开鼓阶显微注射或灌注;经后颅窝内淋巴囊注射;用浸泡治疗介质明胶粘贴圆窗膜;后半规管切开导入等(图28-6)。除用浸泡治疗介质明胶粘贴圆窗膜方法外,其他方法都破坏内耳结构,有损伤听力的危险。这些导入方法不是使转染效率降低,就是对耳蜗内细胞产生损害作用,影响了听功能和耳蜗的完整结构。要想使内耳基因治疗应用到人类,必须找到一种有效途径,这种途径能有效地传递外源基因,并能在整个耳蜗广泛表达,同时使毛细胞损伤减少到最小,耳蜗内平衡的离子梯度不被破坏。
在小鼠耳蜗基因导入手术入路选择上目前国外较多应用的是腹侧入路和耳后入路。我们在实验过程中感觉两者都能很好地暴露圆窗龛,各有优点。腹侧入路时由于视角的关系可以观察到较大范围的耳蜗,但是腹侧入路时由于采用颈部旁正中切口需牵拉气管,影响呼吸;颈前方肌肉厚血管多易出血,动物术中、术后死亡率高。且切口位于小鼠身体下方,术后受压迫,易感染。所以腹侧入路更适合有气管插管的手术条件或有耳蜗打孔要求的实验。我们在体位上取俯卧位颈部垫高、头偏右侧,这样可以使听泡后上部骨壁距体表位置最浅。距耳后沟2mm切开后可使面神经这一重要解剖标志直接位于切口下方,即避免过度牵拉造成面神经损伤;又能使耳廓有良好血运,防止术后耳郭萎缩、外耳道狭窄而影响测听。镫骨动脉由颈总动脉分出后在二腹肌后腹中部穿行进入听泡,所以用小纱条将二腹肌向后钝性分离即可。过度分离二腹肌会损伤镫骨动脉和其下方的后组脑神经。暴露好听泡后壁后要准确找到距离圆窗龛最近的骨壁,我们采用的标志是面神经出听泡处后方略偏上。如果是初次做可以把上方肌肉适当分离,暴露后半规管后在其下方打孔,但是这里肌肉多与骨壁附着,有较多滋养血管,而且听泡与颅骨之间的缝隙有静脉通过,很容易出血。用电钻打孔时要轻,最好是中央处骨壁完全磨掉,听泡内侧黏膜完整,周围骨壁磨薄。然后用小钩针将骨壁及黏膜剔除,打孔直径1mm以内。这时可见镫骨动脉及其上方的圆窗龛。小鼠圆窗龛直径平均0.54mm;圆窗直径平均0.31mm。小鼠的圆窗位于圆窗龛的后下方。在人类圆窗龛内常有假膜及纤维组织覆盖圆窗,小鼠中未发现这种情况,圆窗暴露很好,耳后入路手术过程见书末彩图28-7。
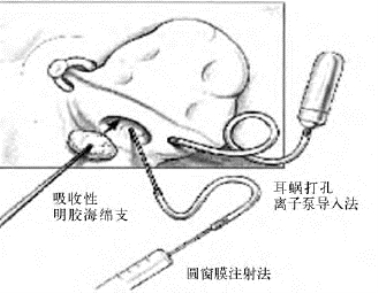
图28-6 内耳基因导入方法
经圆窗鼓阶微渗透泵导入法通过炎症反应明显损伤耳蜗基底圈耳蜗切开的邻近组织,相应部位形成粘连。1999年Carvalho等证实,耳蜗切开鼓阶微渗透泵导入术前后听性脑干反应阈值在低频(1~2kHz)保持不变,中频(4~8kHz)提高<10dB,高频(>16kHz)提高>30dB。1999年Wareing等证实经圆窗鼓阶显微注射后耳蜗细胞结构保持完整,术后两周仍无炎症反应。进一步的研究表明经圆窗鼓阶显微注射不会引起永久的耳蜗听功能下降。
Praetorius等研究经各种入路将切除E1A、E1B、E3、E4区基因带有hCMV启动子的腺病毒(Ad11D)导入CBA小鼠耳蜗后听功能改变情况。未经处理的小鼠在8、16、20kHz频率上平均听阈是25dB。经圆窗膜显微注射导入1~2μl人工外淋巴液后相应频率听阈上升约10dB;圆窗膜显微注射导入2~4μl人工外淋巴液后相应频率听阈提高了40~70dB;当圆窗膜显微注射导入多于1μl Ad11D(108 PU/μl)后,听阈提高了40~70dB,而圆窗膜显微注射1μlAd11D时只引起10dB的听阈提高,0.5μl时听阈无提高。发现导入后24hGFP在螺旋韧带、内毛细胞、螺旋神经元上有很强的表达,在耳蜗其他位置上也有表达。由以上数据可以看出经圆窗膜显微注射引起的听阈提高主要由手术损伤及注射液体的流体力学效应引起,腺病毒的毒性导致的听力下降只占很小一部分。Luebke等研究表明,腺病毒介导的外源基因(Lac Z)在豚鼠外毛细胞表达后,该耳蜗的耳声发射功能仍然保存。这也证实这点,因为豚鼠耳蜗相对小鼠很大,流体力学损伤机制相应较轻。前半规管导入0.5μlAd11D后听力无损失,耳蜗底圈鼓阶切开后注射0.5μl Ad11D导致20dB的听阈提高,说明鼓阶切开对耳蜗结构和功能的影响要大于圆窗膜显微注射方式。
Praetorius等应用立体固定架来固定头部,用36号针头注射等方式来减少手术损伤,因为手术损伤后引起的炎性反应会降低病毒活性。Praetorius等用显微镜下激光鼓阶打孔,避免损伤圆窗膜,使表达效果和术后听力得到显著提高。
在许多实验证实后半规管切开导入腺病毒介导的外源基因后,在6、12、24kHz频率上大约引起10dB的ABR阈值提高,但多表达在前庭系统的感觉上皮和耳蜗外淋巴腔隙周围的间皮细胞上。所以后半规管切开导入法比较适用于外周前庭器官基因导入的研究中。Kohei Kawamoto认为小鼠的外半规管管腔小,在术中很容易导入膜迷路中而造成内外淋巴混合,这也是其不利于基因治疗的一个方面。
1999 年,日本学者Tatsuya Yamasoba将腺病毒+Lac Z(大肠杆菌β-半乳糖苷酶)基因重组体经豚鼠后颅窝注射入内淋巴囊,术后第1天和第4天观察豚鼠的耳廓反射无异常改变,无歪头步态不稳等前庭功能受损表现。在内淋巴管和内淋巴囊的上皮细胞、球囊和椭圆囊感觉区的支持细胞上有明显的外源基因表达。这种导入途径对基因治疗前庭功能异常提供了一个很好的手段。
由于手术操作、外源液体进入耳蜗后引起的炎性反应、显微注射及微渗透泵导入技术都有可能导致内耳损伤。2001年,Jero等开发出一种低侵入性载体导入技术,用渗透有基因转导载体的吸收性明胶海绵将载体外源基因复合物转导入鼠的耳蜗内。渗透入吸收性明胶海绵中的脂质体载体和腺病毒载体(AAV无效)成功地将外源基因通过完整的圆窗膜导入耳蜗内的许多组织中并得到表达。术后发现听泡内渗出较多,但无感染。术后3d,ABR阈值(click)在脂质体组和对照组分别较术前升高13dB、17dB;术后7d分别升高20dB、11dB。证明吸收性明胶海绵技术是一种简单、创伤小、高效但依赖载体种类的转导基因方法。更适用于未来临床上的人类耳蜗基因导入。
(徐延军 郭维维 杨仕明)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















