(一)K+循环的途径
声刺激引起的毛细胞声-电转换导致K+经毛细胞流入鼓阶外淋巴,然后可能经多种不同途径循环进入内淋巴,但这些可能的循环通路尚缺乏足够的实验证据支持。淋巴流动电流的测试提示,进入外淋巴的K+可以流动到螺旋韧带,然后进入血管纹。但最近有很多实验提示K+的回流可能是通过支持细胞完成的。最靠近外毛细胞的支持细胞首先摄取毛细胞释放的K+,然后通过支持细胞的间隙连接依次从Hensen细胞至Claudius细胞,外沟细胞转运至螺旋韧带,在这里,K+通过两种纤维细胞(Ⅰ型和Ⅱ型)转送给血管纹的基底细胞。而内毛细胞释放的K+则可能经内缘细胞、内沟细胞然后经螺旋唇的纤维细胞转运给齿间细胞,后者将其分泌入内淋巴。通常耳蜗中K+的循环途径如图12-1所示。
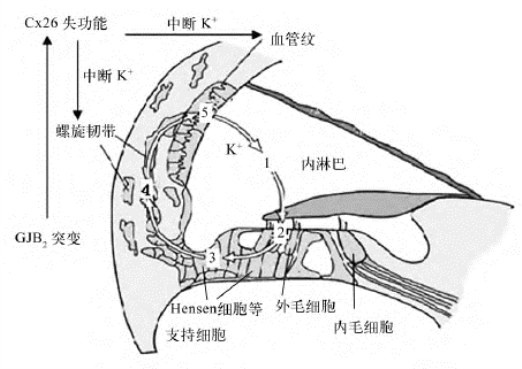
图12-1 耳蜗内K+循环途径
1.内淋巴;2.外毛细胞;3.Hensen细胞等支持细胞;4.螺旋韧带;5.血管纹
随着耳蜗螺旋状的延伸,各处的支持上皮复合物系统的尺寸和结构呈现出极大的差别,相应的侧壁部分的结构也不断地在变化。这使得对于钾离子再循环通路的研究出现了许多争论。首先,Zidanic和Brownell基于电生理测量的结果,提出其以稳定的电流形式经毛细胞返回到螺旋韧带的过程主要是通过鼓阶和前庭阶的外淋巴完成的。而另一方面,Kikuchi等和Spicer及Schulte则提出合胞体样上皮才是钾离子循环的途径。应该指出的是,Zidanic等的结论仅仅是针对豚鼠耳蜗的上部第2、3圈测量的结果。而此处的支持上皮复合物体积缩小,外螺旋沟细胞根部与Ⅱ型纤维细胞之间的接触面最少,这是钾离子经外淋巴循环的原因。与此相反,在耳蜗底圈由于突出的骨缘的存在和随之引起膜部分的胶原化,在鼓阶的外淋巴与螺旋韧带之间形成了分隔。这使得钾离子的弥散发生了障碍,同时也大大降低了其经外淋巴通路循环的可能。其循环特点如下:①K+从血管边缘细胞朝向内淋巴腔一侧的胞膜分泌进入内淋巴以维持内淋巴中高K+状态,以满足毛细胞兴奋的需要;②当IHC、OHC细胞受到机械刺激时,纤毛上的非选择性阳离子通道开启,Ca2+、K+进入毛细胞内,毛细胞兴奋后在底侧壁上的Ca2+依赖性K+通道开启,K+排出至组织间隙;③由支持细胞摄入;④螺旋缘内齿细胞和螺旋韧带,经缝隙连接通道转运到血管纹基底细胞和中间细胞。⑤至内淋巴。
(二)K+循环的细胞生物学基础
耳蜗内淋巴的高K+浓度是由血管纹边缘细胞产生,涉及的转运有下面几种离子转运机制:①经底、侧面细胞膜上的Na+/2Cl-/K+联合转运子摄取K+;②经面对内淋巴顶膜上的K+通道分泌K+;③摄入的Na+和Cl-分别经底、侧膜上的Na+/K+-ATP酶和Cl-通道循环利用。这些转运机制的功能异常均导致内淋巴分泌异常,耳蜗中阶塌陷和听力损失。
在边缘细胞顶膜,K+主要通过KCNQ1/KCNE1通道分泌。KCNQ1代表一个含有6个膜延伸区域和一个孔道形成区域的α亚单位;KCNE1代表一个尚未明了的β亚单位。形成一个功能完全的通道可能需要4 个α亚单位和一个β亚单位。该通道在边缘细胞顶端的存在和功能已经获得确认。当膜电位高于-40mV时,该通道开放,它激活很慢且没有明显的时间依赖性的失活。这些特性很适合它们的工作环境。因为在边缘细胞顶膜,跨膜电位差在0mV~+10mV间(边缘细胞内为正)。目前认为该通道是顶膜处唯一的K+通道,它对K+分泌和内淋巴产生的重要性在基因敲除实验中得到充分证实:无论敲除KCNE1或KCNQ1基因,实验小鼠的共同病变是内淋巴空间在出生3d后(正常K+分泌开始的时间)开始塌陷。
位于边缘细胞底、侧面的Na+/2Cl-/K+联合转运子是由SLC12A2基因编码的专司“分泌性”K+转运的离子通道完成。它的功能在于与Na+/K+-ATP酶共同从血管纹内腔转运/摄取K+。Na+/K+-ATP酶消耗一个ATP以摄取两个K+并排出3个Na+。被排出的Na+建立的Na+梯度提供Na+/2Cl-/K+联合转运子的作用动力,后者协同转运3个Na+,6个Cl-和3个K+进入胞内。可见Na+/2Cl-/K+联合转运子大大提高了边缘细胞转运/摄取K+的效率。在联合转运中协同进入细胞内的Cl-经底、侧壁的Cl-通道排出细胞被循环使用。该通道被证明是血管纹边缘细胞上导纳最高的离子通道,由CLC-NKA(CLCK1)基因编码。基因改造实验证明,如果Na+/2Cl-/K+联合转运子的功能异常,虽然Na+/K+-ATP酶仍然可以摄取一定的K+,致使边缘细胞仍然能分泌一定的K+和水,但是由于与重吸收相比在量上失衡,内淋巴会很快丢失,中阶塌陷。
(三)K+循环对耳蜗功能的意义
毛细胞的上部浸浴在内淋巴中,内淋巴中有比较高的K+浓度和比较低的Na+浓度,从而在内淋巴中保持着大约+100mV的正电位,当内淋巴电位被消减为0时,将会导致耳聋。在Corti器中毛细胞和支持细胞均位于可渗透性的基底膜上,外淋巴位于基底膜下,Na+浓度比较高,K+浓度比较低。内毛细胞被支持细胞所包围,而外毛细胞暴露于Corti淋巴中,Corti淋巴中的K+浓度稍高于外淋巴。这些特殊的离子环境对于毛细胞发挥正常的功能有重要意义。在Na+-K+-ATP酶作用下使胞内为正、胞外为负。此时K+在膜内外的浓度差所致的驱动力和电位差所致的驱动力相平衡时,形成内负外正的静息电位,即K+平衡电位。K+平衡电位是维持蜗内电位(EP)的重要基础,EP实际上是耳蜗内K+的平衡电位。依靠耳蜗内K+循环,维持K+平衡电位,即维持EP,进而维持耳蜗电位(CM、SP、CAP)。当K+失衡后EP下降,就会影响耳蜗电位,如CM、SP等幅度下降,CAP阈值提高。强噪声暴露时耳蜗ATP增加,Hensen细胞外向性K+电流受到抑制,影响耳蜗K+循环,耳蜗功能(CM、CAP)抑制。
耳蜗重要功能之一的电-机械转换过程是刺激依赖性,它依赖于对大量而恒定的钾电流的调制。血管纹作为该电流的起源之处,它的作用是将钾离子分泌到内淋巴中,同时产生+100mV的内淋巴电位。由于静纤毛偏转产生的刺激信号的输入,外毛细胞和内毛细胞顶部的机-电转换通道开放,于是就形成了经过调制的钾电流。内耳的结构特征与其功能是紧密相连的,其优点也是显而易见的。例如,耳蜗与高度血管化的血管纹之间存在着物理间隔,这有助于将血流和脉搏产生的噪声降低到最低程度。此外,钾离子的浓度梯度和内淋巴电位不仅是其换能作用的基础,还可以作为耳蜗能量的储备池,从而最大限度地减少内源性产能的量。同时,由于蛋白质功能复杂程度的降低,可降低其聚集的可能性,从而进一步提高了换能单元的反应特性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















