(一)过碘酸-希夫氏染色(PAS染色)
PAS染色可以显示肾小球内的细胞增生、浸润和系膜基质等,并能很好地显示基底膜,是显示糖原和糖蛋白的基本染色。
1.需要试剂 ①1%过碘酸;②schiff氏液染;③苏木素染液;④氨水。
2.具体染色步骤
(1)切片常规脱蜡入水。
(2)入1%过碘酸氧化10~15min,水洗。
(3)入schiff氏液染10~30min,水洗。
(4)苏木素染细胞核1~2min,水洗。
(5)入1%盐酸乙醇分化数秒,水洗。
(6)氨水返蓝数秒。
(7)流水冲洗,镜下观察细胞核成蓝色,基底膜染成粉红色。
(8)梯度乙醇脱水、二甲苯透明、树胶封片。
3.染色结果 PAS阳性物质(多糖和糖原)呈红色,核呈蓝色(图3-6)。
4.注意事项
(1)组织切片的脱蜡步骤应彻底,否则组织无法着色。
(2)Schiff氏液染色的时间需严格控制。时间过长标本基底膜着色过深,时间过短标本基底膜着色淡(图3-7)。
(3)入1%盐酸乙醇分化时间要短,时间长容易使标本退色。
(4)染色后的组织切片要将组织四周的污染物痕迹擦掉。
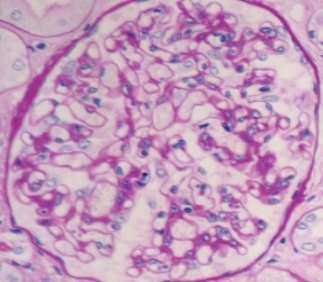
图3-6 PAS染色(×400)

图3-7 PAS染色(×400)(Schiff氏液时间不足,基底膜着色淡)
[1]Qiao X,Chen X,Wu D,et al.Mitochondrial Pathway Is Responsible for Aging-Related Increase of Tubular Cell Apoptosis in Renal Ischemia/Reperfusion Injury.J Gerontol A Biol Sci Med Sci,2005,60:830-839.
[2]Zhang X,Chen X,Hong Q,et al.TIMP-1 Promotes Age-Related Renal Fibrosis Through Upregulating ICAM-1 in Human TIMP-1 Transgenic Mice.J Gerontol A Biol Sci Med Sci,2006,61:1130-1143.
(二)六胺银-马松染色(PAM-Masson染色)
PAM-Masson染色能更清晰地显示基底膜、免疫复合物和胶原纤维,免疫复合物的定位更为精确。
1.需要试剂 ①1%过碘酸;②六胺银液;③苏木素染液;④氨水;⑤Masson液;⑥1%亮绿液。
2.具体染色步骤
(1)切片常规脱蜡入水。
(2)入1%过碘酸氧化10~15min,水洗5min。
(3)入六胺银液72℃染30~50min,以显微镜下见基底膜呈黑色即可。
(4)加2%氯化金数滴于组织,5%硫代硫酸钠洗。
(5)苏木素染细胞核1~2min,1%盐酸乙醇分化,氨水返蓝。
(6)入Masson液约10min,1%醋酸洗。
(7)入1%亮绿5~8min,1%醋酸洗。
(8)梯度乙醇脱水、二甲苯透明、树胶封片。
3.染色结果 基底膜及系膜基质黑色,免疫复合物红色(图3-8)。
4.注意事项
(1)组织切片的脱蜡步骤应彻底,否则组织无法着色。
(2)染色时间与室温和切片厚度有关,室温低、切片厚需染色时间长,反则需染色时间短。入六胺银液染色的时间需严格控制。时间过长基底膜着色过深,时间过短基底膜着色淡(图3-9)。
(3)2%氯化金分化时间要短,时间长容易使银染退色。
(4)染色后的组织切片要将组织四周的污染物痕迹擦掉。

图3-8 正常PAM-Masson套染色(×400)

图3-9 PAM-Masson套染色(×400)(银染时间过长,Masson套染时着色不良)
参考文献
[1]尹忠,师锁柱,张雪光,等.大鼠肾组织PAM染色法改良[J].军医进修学院学,2004,25:271.
[2]尹忠,师锁柱,张雪光,等.肾活检病理组织切片PAM-Masson染色法改良[J].中国中西医结合肾病杂志,2008,9:859.
(三)马松染色(Masson染色)
Masson染色能显示各部位的免疫复合物,肾小球硬化和肾间质纤维化程度。
1.需要试剂 ①苏木素染液;②氨水;③Masson液;④1%亮绿液。
2.具体染色步骤
(1)切片常规脱蜡入水。
(2)媒染剂(10%重铬酸钾、10%三氯醋酸等量混合)染10~30min,水洗。
(3)苏木素染细胞核1~2min,水洗。
(4)入1%盐酸乙醇分化数秒,水洗,氨水返蓝数秒,水洗。
(5)入Masson液约10min,水洗,1%醋酸洗。
(6)入2.5%磷钨酸约30s,水洗,1%醋酸洗。
(7)入2%橘黄G约2min,水洗,1%醋酸洗。
(8)入1%亮绿5~8min,1%醋酸洗。
(9)入100%乙醇脱水、二甲苯透明、树胶封片。
3.染色结果 细胞核红色,胶原纤维绿色,免疫复合物红色(图3-10)。
4.注意事项
(1)组织切片的脱蜡步骤应彻底,否则组织无法着色。
(2)入Masson液染色的时间需严格控制。时间过长着色过深,时间过短着色淡(图3-11)。
(3)入1%亮绿染色时间需要镜下控制,时间长容易覆盖Masson液红色。
(4)染色后的组织切片要将组织四周的污染物痕迹擦掉。

图3-10 正常Masson染色(×400)

图3-11 Masson染色(×400)(Masson染色时间不足,经色淡)
参考文献
[1]Zhang Y,Chen X,Wu D,et al.Expression of tissue inhibitor of matrix metalloproteinases-1 during aging in rat liver.World J Gastroenterol,2005,11:3696-3700.
[2]Zhang Y,Chen X,Wu D,et al.Expression of tissue inhibitor of matrix metalloproteinase-1 in aging of transgenic mouse liver.Chin Med J,2006,119:504-509.
[3]师锁柱,田月,陈香美,等.微波Masson染色法在肾活检病理诊断中的应用.中华肾脏病学杂志,2002,18:298.
(四)刚果红染色
在肾脏病理染色中,刚果红染色能够将淀粉样物质染成砖红色,是诊断淀粉样变肾病的常用染色方法之一。
1.需要试剂 ①高锰酸钾—硫酸液;②苏木素染液;③氨水;④碱性刚果红液。
2.具体染色步骤
(1)切片常规脱蜡入水。
(2)高锰酸钾-硫酸混合处理3min,水洗。
(3)5%草酸处理3min,水洗。
(4)苏木素染核2min,水洗,蓝化。
(5)碱性刚果红液染10~30min。
(6)入100%乙醇脱水、二甲苯透明、树胶封片。
3.染色结果 细胞核蓝色,淀粉样物质呈砖红色(图3-12)。

图3-12 刚果红染色(×400)
4.注意事项
(1)组织切片的脱蜡步骤应彻底,否则组织无法着色。
(2)碱性刚果红液染色时间应该镜下控制,染色液现配现用着色好。
(4)染色后的组织切片要将组织四周的污染物痕迹擦掉。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














