李巧1,陈又清2,李从富3,冯永刚3,李庆元3,赵志华3
(1北京林业大学 资源与环境学院,北京 100083;2中国林业科学研究院 资源昆虫研究所,云南 昆明 650224;3 元谋县林业局,云南 元谋 651300)
摘要:在元谋干热河谷采用震落法对10种植被类型的象甲多样性进行调查。结果如下:3种类型的自然生态系统中,云南松-栎林个体数量最多、物种最丰富、狭栖种最多、优势度最低、多样性最高,而牛筋条-黄荆林和明油子-扭黄茅灌草丛物种较贫乏、无狭栖种、多样性较低;7种类型的人工生态系统中,石榴林象甲个体数量较多、物种较丰富、狭栖种较多、优势度较低、均匀度较高,是多样性最高的人工生态系统;杧果林次之,云南松林物种丰富度低于石榴林及杧果林,高于其他恢复时间较短的人工生态系统及处于退化的牛筋条-黄荆林和明油子-扭黄茅灌草丛,同时具有较多的狭栖种;印楝-明油子林、木豆-余甘子林和印楝-久树林在恢复过程中尚未形成多样性较高的象甲群落;龙眼林、杧果林和石榴林,农药使用频繁,其象甲群落主要建立在林下的草本及地被物层。象甲物种多样性与土壤养分、植被恢复时间长短、恢复措施和经营措施存在一定关系。
关键词:象甲总科;物种多样性;相似性;干热河谷
元谋干热河谷主要植被类型是扭黄茅稀树灌草丛,属干热性稀树灌草丛[1],也称“半萨王纳植被”、“河谷型萨王纳植被”,是我国一类珍稀濒危的植被类型[2,3],气候恶劣加之地形地势及人为破坏因素等导致了生态环境的脆弱[4],其生态系统表现为硬叶栎类林-稀树灌木草丛-灌木草丛-草丛-稀草草坡-光板地或裸岩的退化序列[5]。
自国家实施西部大开发战略、退耕还林工程以来,元谋干热河谷脆弱生态区植被恢复研究有较大进展[6-12]。然而,元谋干热河谷脆弱生态区包括象甲在内的昆虫群落研究尚属空白。
象甲隶属于鞘翅目Coleoptera象甲总科Curculionoidea,种类极多,分布广泛,直接以寄主植物为食,栖息在植物上,其群落组成强烈依赖于植被,同时,对植被的变化非常敏感,可以作为生物指示物来反映栖境的变化[13-16]。本研究以元谋干热河谷脆弱生态区象甲类群作为研究对象,通过考察不同植被类型的自然生态系统和人工生态系统象甲群落的多样性差异,比较自然生态系统和人工生态系统象甲类群间相似性,探索性评价生态恢复的效果。该研究对于退耕还林工程和脆弱生态区植被恢复具有一定参考意义。
1 研究地概况
元谋地处滇中高原中北部,横断山区的东部,金沙江一级支流龙川江的中下游,地理坐标为25°23´~26°06´N,101°35´~102°06´E之间, 面积2021.47km2,干热区面积(海拔1350m以下)1434 km2。本研究在10种不同植被类型的自然生态系统和人工生态系统中设置样地。自然生态系统包括云南松-栎林、牛筋条-黄荆林及明油子-扭黄茅灌草丛,人工生态系统包括云南松林、印楝-明油子林、木豆-余甘子林、印楝-久树林、杧果林、龙眼林、石榴林。
2 研究方法
2.1 取样方法和标本鉴定
利用震落法在每个样地内随机进行标本采集。于2004年6-8月进行3次调查,鉴定及分析采集标本。
根据《中国经济昆虫志鞘翅目象虫科(一)》及相关资料[17-23]将标本鉴定到亚科、属、种。对于不能鉴定到种的种类,作为形态种对待[24-25]。
2.2 数据处理
群落内的多样性测度采用物种丰富度指数、物种多样性指数和均匀度指数[26]。物种丰富度指数采用物种丰富度S,即物种的数目,以及Margalef指数;物种多样性指数采用Shannon-Wiener指数;物种优势度采用Simpson优势度指数;均匀度指数采用Pielou指数和Alatalo指数。群落间的多样性测度采用Jaccard指数进行定性测度,采用Moristia-Horn指数进行定量测度。
本文Margalef指数为:dMa= (S-1) / lnN, 式中N为所有种类的个体数量之和,S为物种数目。Shannon-Wiener指数为:H´= -ΣPilnPi(i = 1,2,3……S),式中Pi为第i个种类的个体数量和N之比, S同上。Simpson优势度指数为:C = ΣPi2(i = 1,2,3……S),式中Pi、S同上。Pielou指数为: Jsw= (-ΣPilnPi) / lnS(i = 1,2,3……S),式中Pi、S、N同上。Alatalo指数为: Ea= [(ΣPi2)-1-1] / [exp(-ΣPilnPi)-1],式中Pi同上。
Jaccard指数及Moristia-Horn指数利用EstimateS (Version 7.5.0)软件计算[27]。
3 结果与分析
3.1 主要类群及数量
经过初步鉴定和数量统计,共采获象甲总科昆虫标本667号,计23种(表1)。
表1 2004年在元谋干热河谷10个样地采集的象甲类群和标本数量
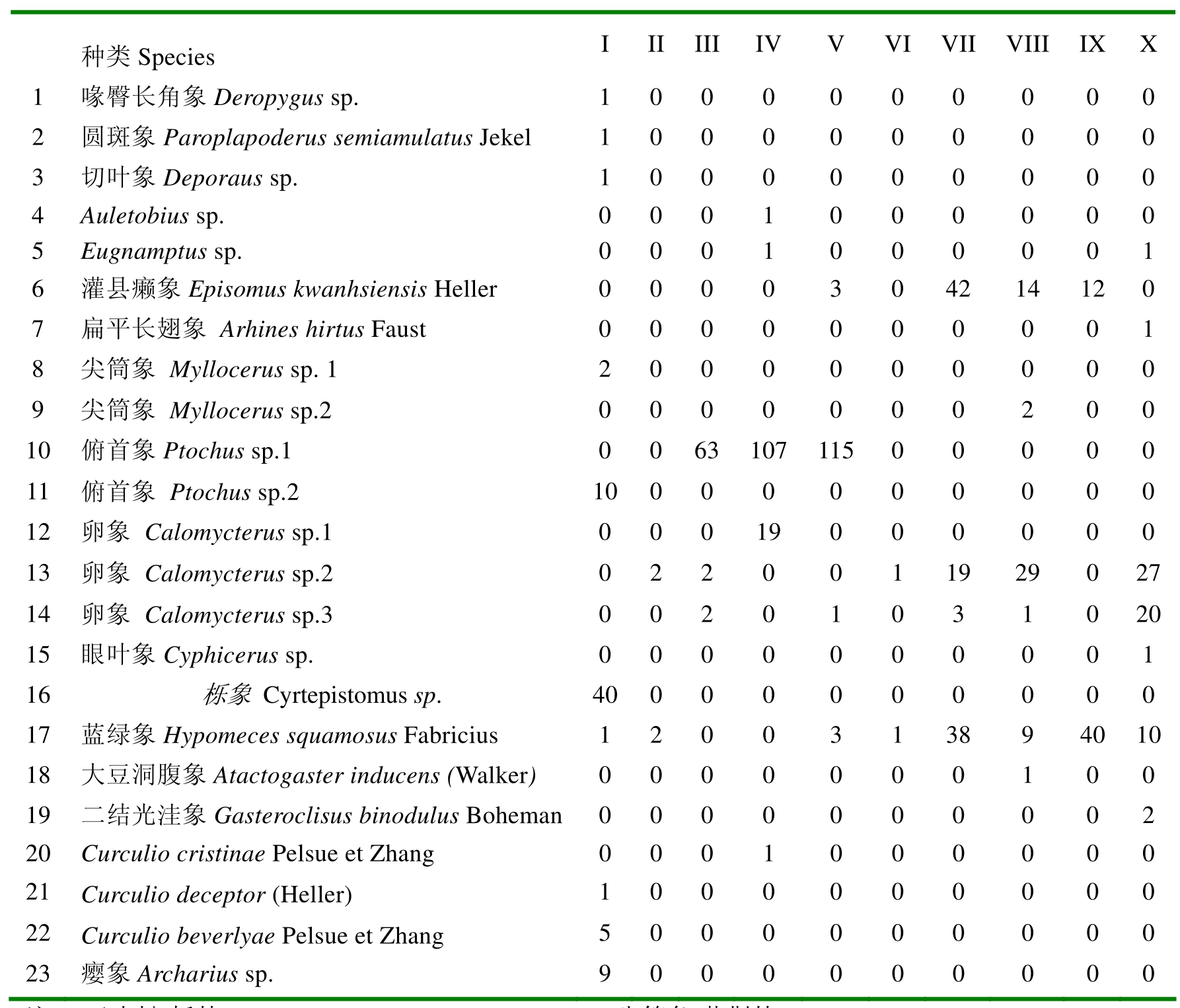
注:I云南松-栎林Pinus yunnanensis-Quercus forest,II牛筋条-黄荆林Dichotomanthus tristaniaecarpa-Vitex negundo forest,III明油子-扭黄茅灌草丛Dodonaea angustifolia-Heteropogonetea contortus scrub and grass clump,IV云南松林 Pinus yunnanensis plantation forest,V印楝-明油子林Azadirachta indica-Dodonaea
angustifolia plantation forest,VI木豆-余甘子林Cajanus cajan-Phyllanthus emblica plantation forest,VII印楝-久树林Azadirachta indica-Schleichera oleosa plantation forest,VIII杧果林Mangifera indica plantation forest,IX龙眼林 Dimocarpus longan plantation forest. X石榴林Punica granatum plantation forest.下同。I-III自然生态系统natural ecosystem, IV-X人工生态系统artificial ecosystem. The same below.
3.2 狭栖种及优势种分析
狭栖种在此处指仅存在于1个样地中的象甲种类。10个样地的象甲群落仅有4个样地具有狭栖种,其中云南松-栎林狭栖种最丰富,有9种;云南松林和石榴林次之,有3种;龙眼林有2种;其他样地只有广栖种而无狭栖种。
优势种指物种个体数占样地个体总数大于10%的种类。云南松-栎林的优势种是栎象Cyrtepistomus sp.、俯首象 Ptochus sp.2和瘿象Archarius sp.,这3种均属狭栖种;云南松林的优势种是俯首象 Ptochus sp. 1和卵象 Calomycterus sp. 1,前者属广栖种,后者属狭栖种;其他样地的优势种均属广栖种,如明油子-扭黄茅灌草丛和印楝-明油子林的优势种俯首象Ptochus sp.1,印楝-久树林和杧果林的优势种蓝绿象Hypomeces squamosus Fabricius、卵象 Calomycterus sp.2及灌县癞象Episomus kwanhsiensis Heller。
3.3 物种多样性分析
3.3.1 物种丰富度分析 物种丰富度S值和Margalef指数反映的结果不尽一致(表2):根据物种丰富度S值,10个样地的物种丰富度以云南松-栎林最高,石榴林次之,牛筋条-黄荆林、木豆-余甘子林及龙眼林最低。反映出天然次生的云南松-栎林具有最丰富的象甲类群,而天然次生的牛筋条-黄荆林由于植被组成单一,其象甲类群不及云南松林、印楝-明油子林等一些人工生态系统。人工生态系统中,石榴林具有最丰富的象甲类群,以生活于农田草本植物上的卵象占优势,反映出其象甲群落仍保留着农田的特点。而Margalef指数以云南松-栎林最高,石榴林次之,龙眼林最低。物种丰富度S值直接反映出各样地物种数目的区别,不能体现相同物种数目情况下个体数量的差异;Margalef指数用物种数目与个体总数的一定数学关系来测度,反映出物种数目随样方增大而增大的速率,能体现出物种数目相同的样地之间丰富度的差异。然而,对于物种单调、个体数量较少且分布均匀的样本,其反映结果不佳。如木豆-余甘子林仅有2种象甲,其丰富度指数却高达1.443,位居第3。
表2 2004年在元谋干热河谷10个样地采集的象甲个体数量以及物种多样性指数的计算
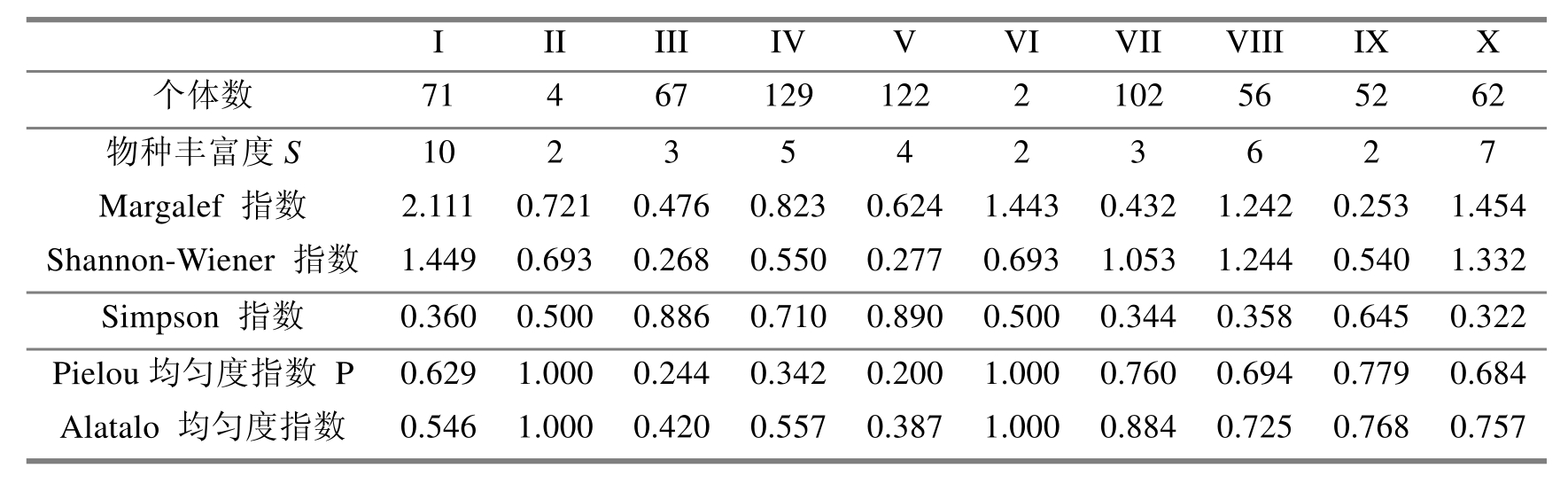
3.3.2物种多样性指数比较 Shannon-Wiener物种多样性指数最高的是云南松-栎林,石榴林次之,明油子-扭黄茅灌草丛最低(表2),反映出云南松-栎林的象甲总科物种多样性最丰富,而天然次生的明油子-扭黄茅灌草丛物种多样性最低,而石榴林象甲多样性仅低于天然次生的云南松-栎林,高于其他任何的自然和人工生态系统。
3.3.3物种优势度及均匀度分析 9种植被亚型的优势度指数及均匀度指数均表现出较大差异。Simpson优势度指数最高的是印楝-明油子林,明油子-扭黄茅灌草丛次之,石榴林最低。Pielou指数最高的是牛筋条-黄荆林和木豆-余甘子林,龙眼林次之,印楝-明油子林最低。而Alatalo指数最高的是: 牛筋条-黄荆林和木豆-余甘子林,印楝-久树林次之,印楝-明油子林最低(表2)。由于Pielou指数受到样本大小的强烈影响,而Alatalo指数对样本大小不敏感,因此,用这两种指数测度的结果有一定差异。牛筋条-黄荆林和木豆-余甘子林均匀度指数为1,在所有样地中均匀性最高,这是由于牛筋条-黄荆林和木豆-余甘子林样地内象甲物种单调所致。3种指数均反映出明油子-扭黄茅灌草丛和印楝-明油子林象甲群落的优势度较高而均匀性较低。
3.4 群落相似性分析
3.4.1群落相似性定性分析 10个样地的Jaccard相似性系数变动较大,q值在0.000-1.000之间。其中,牛筋条-黄荆林和木豆-余甘子林的相似性指数最大,为极相似水平,在10个样地中相似性最大;牛筋条-黄荆林和印楝-久树林、印楝-明油子林和印楝-久树林、印楝-明油子林和龙眼林、印楝-久树林和杧果林、印楝-久树林和龙眼林、木豆-余甘子林和印楝-久树林之间q值在0.500~0.750之间,为中等相似水平;其他样地之间为中等不相似或极不相似水平,以云南松-栎林和明油子-扭黄茅灌草丛、云南松-栎林和云南松林、牛筋条-黄荆林和云南松林、明油子-扭黄茅灌草丛和龙眼林、云南松林和木豆-余甘子林、云南松林和印楝-久树林、云南松林和杧果林、云南松林和龙眼林之间相似性最低(表3)。
3.4.2群落相似性定量分析 Morisita-Horn相似性指数显示:牛筋条-黄荆林和木豆-余甘子林的象甲类群之间相似性最大,明油子-扭黄茅灌草丛和印楝-明油子林、云南松林和印楝-明油子林、明油子-扭黄茅灌草丛和云南松林之间相似性较大,而云南松-栎林和明油子-扭黄茅灌草丛、云南松-栎林和云南松林、牛筋条-黄荆林和云南松林、明油子-扭黄茅灌草丛和龙眼林、云南松林和木豆-余甘子林、云南松林和印楝-久树林、云南松林和杧果林、云南松林和龙眼林、云南松林和石榴林之间相似性最低(表4)。
表3 元谋干热河谷10个样地象甲群落的Jaccard相似性系数(q值)

表4 元谋干热河谷10个样地象甲群落的Morisita-Horn相似性系数

4 结论与讨论
元谋干热河谷3种类型的自然生态系统的象甲群落差异性显著,云南松-栎林和牛筋条-黄荆林、明油子-扭黄茅灌草丛之间处于极不相似水平。其中,云南松-栎林象甲个体数量最多、物种最丰富、狭栖种最多、优势度最低、多样性最高;而牛筋条-黄荆林和明油子-扭黄茅灌草丛物种较贫乏、无狭栖种、多样性较低。可见,牛筋条-黄荆林和明油子-扭黄茅灌草丛这2种自然生态系统处于退化阶段。因此,有必要在进行管护的同时,加以改造,层次结构简单的明油子-扭黄茅灌草丛尤应如此。
元谋干热河谷7种类型的人工生态系统的象甲群落亦存在一定的差异性。石榴林象甲个体数量较多、物种较丰富、狭栖种较多、优势度较低、均匀度较高,是多样性最高的人工生态系统;杧果林次之。这两种人工生态系统均属于在水肥条件较好的农田上重建的人工生态系统,由于重建时间的差异,石榴林比杧果林保留了更多的农田昆虫群落特征。这两种人工生态系统的土壤养分较其他人工生态系统肥沃,其象甲群落物种多样性亦高于其他人工生态系统,显示了象甲物种多样性与土壤养分之间的微妙关系,这与Hemerik在草地恢复过程中土壤大型无脊椎动物多样性的研究结果相类似[15]。
恢复时间长短对象甲群落多样性有一定影响。恢复时间长达30余年的云南松林物种丰富度低于水肥条件较好的石榴林及杧果林,高于其他恢复时间较短的人工生态系统及处于退化的牛筋条-黄荆林和明油子-扭黄茅灌草丛,狭栖种数量较多且具有一定优势,反映出恢复时间对物种丰富度和狭栖种的影响;而物种多样性指数及均匀度指数却偏低,体现了以云南松为单优种的恢复措施的不足,应适当种植阔叶树种,构建针阔混交林,并适当增加灌木盖度,促进生态系统的进一步恢复。其他恢复时间较短的人工生态系统如印楝-明油子林、木豆-余甘子林和印楝-久树林,在恢复过程中尚未形成多样性较高的象甲群落,需要继续恢复。龙眼林、杧果林和石榴林由于经营的需要,农药使用频繁,其象甲群落主要建立在林下的草本及地被物层。这3种经济林的狭栖种数目也极不一致,造林时间最长的杧果林无狭栖种,造林时间最短的石榴林狭栖种最丰富,反映出狭栖种数目随造林时间或恢复时间增加而递减的现象;然而,狭栖种在群落中不具有明显优势,可能会随时间的推移而减少甚至丢失。
从生物多样性保护的角度出发,栖境异质性的保护十分重要。在退耕地上进行生态系统重建,尤其是发展经济林果,会造成一些农田成分的物种减少并丢失,解决的办法之一是尽量保留部分原有的灌木及杂草,增加栖境异质性。
[1] 吴征镒, 朱彦丞. 云南植被[M]. 北京: 科学出版社. 1987. 74-76.
[2] 金振洲, 欧晓昆, 周 跃. 云南元谋干热河谷植被概况[J]. 植物生态学与地植物学学报, 1987,11(4): 308-317.
[3] 金振洲, 欧晓昆. 干热河谷植被[M]. 昆明: 云南大学出版社,云南科技出版社. 2000. 12-13.
[4] 刘燕华,刘秀彬. 脆弱生态环境可持续发展[M]. 北京: 商务印书馆.2001. 204-205.
[5] 钟祥浩. 干热河谷区生态系统退化及恢复与重建途径.长江流域资源与环境[J]. 2000, 9(3): 376-383.
[6] 周 跃. 元谋干热河谷植被的生态及其成因[J]. 生态学杂志, 1987, (5): 39-43.
[7] 周 麟. 云南元谋干热河谷植被恢复初探[J]. 西北植物学报, 1998,18(3): 750-756.
[8] 崔书红. 云南元谋干热河谷土地退化及其防治对策[J]. 地理研究, 1995,14(1): 66-71.
[9] 张信宝, 陈玉德. 云南元谋干热河谷区不同岩土类型荒山植被恢复研究[J]. 应用与环境生物学报, 1997,3(1): 13-18.
[10] 柴宗新, 范建容. 金沙江干热河谷植被恢复的思考[J].山地学报, 2001,19(4):381-384.
[11] 陈利顶, 王 军, 傅伯杰. 2001. 我国西南干热河谷脆弱生态区可持续发展战略[J]. 中国软科学, (6): 95-99.
[12] 张信宝, 杨 忠, 张建平. 元谋干热河谷区坡地岩土类型与植被恢复分区[J]. 林业科学, 2003,39(4): 16-22.
[13] 赵养昌,陈元清.中国经济昆虫志第二十册 象虫科(一)[M]. 北京:科学出版社, 1980.1-184.
[14] Samways M J. Some comparative insect conservation issues of north temperate, tropical, and south temperate landscapes [J]. Agriculture Ecosystems and Environment, 1992, 40: 137-154.
[15] Hemerik L, Brussaard L. Diversity of soil macro-invertebrates in grasslands under restoration succession[J]. European Journal of Soil Biology, 2002,38: 145-150.
[16] Fabricius C, Burger M, Hockey P A R. Comparing biodiversity between protected areas and adjacent in
xeric succulent thicket, South Africa: arthropods and reptiles [J]. Journal of Applied Ecology, 2003, 40: 392-403.
[17] Marshall G A K. Fauna of British India: Curculionidae I: Brachyderinae, Otiorhynchinae[M]. London, Taylor and Francis, 1916.1-367.
[18] Pajni H R. Fauna of India and adiacent countries. Coleoptera: Curculionidae: Eremninae: Cyphicerini[M]. Technical & General Press, Calcutta, 1990. 1-568.
[19] Yoshihisa S. A systematic study of the family Rhynchitidae of Japan (Coleoptera, Curculionoidea) [J]. Human and Nature, 1993,2: 1-93.
[20] 陈元清. 鞘翅目: 象虫科[A]. 黄复生主编.云南森林昆虫[C].昆明:云南科技出版社, 1987.801-819.
[21] 张润志. 1993 中国长角象科分属鉴定(鞘翅目:象虫总科) [A].中国科学院动物研究所编辑. 动物学集刊第十集[C].北京:科学出版社, 201-206.
[22] Alonso-Zarazaga M A, Lyal C H C. A world catalogue of families and genera of Curculionoidea (Insecta: Coleoptera)(excepting Scolytidae and Platypodidae) [M]. Entomopraxis, S. C. P. Edition, 1999.1-315.
[23] Pelsue F W, Zhang R Z. A review of the genus Curculio L. from China with descriptions of new taxa. Part I(Coleoptera: Curculionidae: Curculioninae: Curculionini) [J]. The Coleopterist Bulletin, 2000, 54(2): 125-142
[24] Schnell M R, Pik A J, Dangerfield J M. Ant community succession within eucalypt plantations on used pasture and implications for taxonomic sufficiency in biomonitoring[J]. Austral Ecology, 2003, 28: 553-565.
[25] Burger J C, Redak R A, Allen E B, Rotenberry J T, Allen M F. Restoring Arthropod communities in coastal sage scrub[J]. Conservation Biology, 2003, 17: 460-467.
[26] 马克平. 生物群落多样性的测度方法[A].中国科学院生物多样性委员会.生物多样性研究的原理和方法[C]. 北京:中国科学技术出版社, 1994.141-165.
[27] Colwell R K. EstimateS: Statistical estimation of species richness and shared species from samples[EB/OL].2005, Version 7.5. User's Guide and application published at: http://purl.oclc.org/estimates.
Initial Study on Weevil Diversity in Arid-hot Valleys, Yuanmou, Yunnan
LI Qiao1,CHEN You-qing2,LI Cong-fu3,FENG Yong-gang3,LI Qing-yuan3,ZHAO Zhi-hua3
(1 College of Forest Resources and Environment, Beijing Forestry University, Beijing 100083,China;2 Research Institute of Resources Insects, CAF, Kunming, 650224, Yunnan, China;3 Forestry Bureau of Yuanmou County, Yuanmou, 651300,Yunnan, China)
Abstract: Weevil diversity was investigated in 10 vegetation types by shaking –off collection in Arid- hot valleys, Yuanmou, Yunnan. The results were as follow: In 3 natural ecosystems, captured individuals, species and stenoecious species were the most, predominant index was the lowest, diversity index was the highest in Pinus yunnanensis-Quercus forest, and there were less species, no stenoecious species, low diversity index in Dichotomanthus tristaniaecarpa-Vitex negundo forest and Dodonaea angustifolia-Heteropogonetea contortus scrub and grass clump. In 7 artificial ecosystems, captured individuals, species and stenoecious species were the most, predominant index was the lowest, diversity index and evenness index were the highest in Punica granatum plantation forest, for these 6 indexes, Mangifera indica plantation forest had the second place. Species richness in Pinus yunnanensis plantation forest was lower than that in Punica granatum plantation forest and in Mangifera indica plantation forest, Species richness and stenoecious species were higher than those in other artificial ecosystems, and in Dichotomanthus tristaniaecarpa-Vitex negundo forest and in Dodonaea angustifolia-Heteropogonetea contortus scrub and grass clump. Weevil community with higher diversity has not been formed in Azadirachta indica-Dodonaea angustifolia plantation forest, Azadirachta indica-Schleichera oleosa plantation forest and Cajanus cajan-Phyllanthus emblica plantation forest. Weevils can only be found in grass and ground cover for pesticide usage in Dimocarpus longan plantation forest, Mangifera indica plantation forest and Punica granatum
plantation forest. There were certain relationships between weevil diversity and soil nutrient, restoration time, restoration way, and management way.
Keywords:Curculinonoidea;species diversity; similarity;Arid-hot Valleys;
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














