木豆种子超干保存最适含水量的选择及其机制分析
崔 凯12,李 昆1,2,李 立1,孙永玉1
(1.中国林业科学研究院资源昆虫研究所,昆明650216;
2.国家林业局云南元谋荒漠生态系统定位研究站,昆明650224)
摘 要:将木豆种子脱水干燥至1.17%~7.12%7个含水量梯度,在常温下保存一年,结合不同的回湿处理测定其发芽率、脯氨酸(Pro)含量、丙二醛(MDA)含量、总糖含量和脂肪酸组分5项指标。结果表明,木豆种子较为适宜的脱水范围为4.03%~7.12%,在此范围内经过回湿处理其发芽率都在60%以上,保存效果优于常温保存下的未经脱水的种子(CK1);其中以4.94%含水量种子保存效果最佳,其发芽率高达75%。对4项生理生化指标的测定显示:适宜的脱水和回湿处理使种子的脯氨酸含量、脂肪酸不饱和指数增加,总糖含量降低,种子膜质过氧化减轻,从而使种子保持较高的生活力。
关键词:木豆种子;超干燥保存;膜质过氧化;脂肪酸组分
木豆〔Cajanus cajan(L.)Millspaugh〕是热带、亚热带多年生常绿灌木,其植株可作为紫胶虫寄主,籽粒可食用,干、茎叶是良好的饲料,叶片兼有多种药用价值[1~7]。其耐高温、干旱、瘠薄、具根瘤菌可固氮(固氮量每年200 kg·hm-2),有共生真菌,可活化岩石中的磷酸铁吸收磷,能利用自然降水在没有灌溉条件下的荒山荒坡能迅速生长,在我国被广泛用于广西、贵州、四川和重庆喀斯特地区和云南干热河谷等地区植被恢复和生态建设中[8-10]。因此合理保存和利用这一优良资源意义重大。由于木豆种子在贮存期受豆象[Callosobruchs maculates(F.)]危害十分严重(自然存放3~5个月后,至少80%甚至100%的木豆种子受虫害)[11],而且种子在常温下贮存,生活力下降比较快,目前能同时防止虫害和避免木豆种子生活力下降的最有效方法还是低温保存。
超干燥保存是20世纪80年代发展起来的一项现代保存技术,近20年来在国内外已有许多成功应用超干燥方法保存植物种子的研究被报道。超干燥种子保存技术具有简便易行、节省空间、避免病虫害和气候不良因素、经济成本低等优势[12-14]。鉴于目前国内外关于木豆种子超干燥保存的研究尚无报道,笔者以木豆种子为试验材料经脱水处理后于常温下密封保存,并研究了其保存后一些生理生化指标的变化情况,旨在探索木豆种子超干保存的可行性并对其机制进行分析,为超干储存种质研究提供一定的理论依据。
1 材料与方法
试验用材料于2006年4月上旬采自云南省元谋干热河谷,采集时选择性状优良母树上的成熟饱满种子,采集后经晾晒处理于4℃冰箱保存。试验时种子的初始含水量为8.13%。
1.1 种子含水量梯度的获得
将种子置于盛有变色硅胶的干燥器内(硅胶重量与种子比例为6∶1),结合50℃烘箱烘干,每隔12小时对种子称重并且更换硅胶,最终得到1.17%、2.23%、3.34%、4.03%、4.94%、6.08%、7.12%7个含水量梯度(其中采用硅胶在常温下对种子脱水获得高含水量梯度,硅胶结合50℃烘箱对种子脱水获得低含水量梯度)。以在室温保存的自然含水量(不经失水处理)状态下种子为对照1(CK1),以在4℃冰箱保存的种子为对照2(CK2)。
1.2 种子含水量测定
参照宋松泉等[15]的烘干法,以湿重为基数计算种子含水量,用称量法测定种子含水量[16]。试验3个重复,取平均值。
1.3 超干保存和回湿处理
将获得的不同含水量梯度种子装入铝箔袋(20cm×14cm),用封口机真空密封,在室温下保存1年。取出时,采用3种方法进行处理:①①不经回湿;②室温下回湿48h后用人工气候箱回湿48h(25℃,100%RH),文中简称室内回湿;③用20%浓度的PEG(聚已二醇,分子量6 000)回湿12h,简称PEG回湿。处理后的种子进行发芽试验和一些生理生化指标测定,其中总糖含量测定和脂肪酸含量测定是选用不经回湿处理的种子。
1.4 发芽试验
参照《国际种子检验规程》的规定,采用两层滤纸法。各试验4个重复,每重复50粒。计算出种子的发芽率。
1.5 测定项目
MDA含量的测定采用硫代巴比妥酸(TBA)法[17];Pro含量测定采用茚三酮比色法[17];各项指标在测定时做3次重复,取平均值。总糖含量和脂肪酸组分委托农业部农产品质量监督检验测试中心(昆明)测定。总糖含量的测定参照GB/T 5009.7-2003中的3,5-二硝基水杨酸比色法,脂肪酸测定参照GB/T 17377-1998中动植物油脂脂肪酸甲脂的气象色谱分析。
1.6 实验主要仪器和药品
101A-2电热鼓风恒温干燥箱(上海市崇明实验仪器厂);电脑多功能真空包装机(浙江葆春包装机械总厂);RX-智能型人工气候箱(宁波江南仪器厂);BECKMAN COULTER DU800分光光度计;HERMLE Z323K超速冷冻离心机;METTLER TOLEDO DL22滴定仪;METTLER TOLEDO AL204万分之一电子天平;实验中所用的化学药品均为分析纯。
1.7 数据处理
试验数据用SPSS 13.0进行分析,分析前数据经必要的标准化处理(其中结果为百分数的数据经平方根反正旋变换)。
2 结果与分析
2.1 种子超干保存最适含水量的选择
图1 不同处理种子的发芽率比较
试验结果表明(如图1),在对种子进行脱水过程中,其发芽率的变化总体上呈单峰曲线变化,不同含水量的种子其发芽率有明显差异,7.12%和6.08%含水量种子的发芽率在55%~60%之间,4.94%含水量种子的发芽率达到最高(>70%),此后随着种子含水量的降低,发芽率呈下降趋势。特别是当含水量降到2.23%时,发芽率从40%左右骤降至20%左右;含水量1.17%时,发芽率不足5%。与对照相比,3.34%~7.12%5个含水量梯度种子的发芽率均高于常温保存下种子(CK1)的发芽率,但是7个水分梯度的发芽率均低于低温保存种子(CK2)的发芽率(80%)。
不同的回湿处理对种子发芽率亦有一定影响,如含水量7.12%种子在不经回湿处理时发芽率为55%;经室内回湿处理,发芽率为63%;经PEG回湿处理,发芽率为59%。含水量4.94%种子不经回湿、室内回湿和PEG回湿的发芽率分别为71%、75%和74%。各含水量种子经过回湿处理后,与不经回湿相比,发芽率都有所提高;从2.23%~7.12%6个水分梯度来看,室内回湿比PEG回湿的效果要好,在1.17%含水量中则相反,但差异不大。

以上表明,木豆种子脱水范围在3.34%~7.12%时,其保存效果优于常温保存,其中以4.94%含水量保存效果最佳,结合室内回湿处理后,其发芽率达到75%,接近于在低温保存的效果(发芽率80%)。
2.2 不同处理种子的MDA含量比较

图2 不同处理种子的MDA含量比较
在逆境中的植物,细胞原生质膜中的不饱和脂肪酸会发生过氧化作用产生MDA,MDA进一步可与蛋白质、核酸、氨基酸等活性物质交联,形成不可溶的化合物,从而干扰细胞正常生命活动,使质膜系统受到伤害。MDA含量在一定程度上反映了植物体内自由基含量,即MDA越少,自由基含量越低[18-20]。图2表明,MDA含量变化与种子发芽率变化呈显著的负相关(P<0.05),即MDA含量可以很好的反映种子生活力的保持状况,MDA含量越低,种子发芽率越高。3.34%~7.12%含水量种子的MDA含量与CK1差别不大,但是1.17%和2.23%含水量种子MDA含量远远超出了其他种子,这说明脱水至2.23%以下时,种子膜质过氧化加剧,其质膜系统严重受损,从而导致种子生活力迅速降低。7个水分梯度种子的MDA含量都明显高于CK2,说明脱水处理对种子膜系统造成了不同程度的伤害。同一含水量,种子经过2种回湿处理后,其MDA含量要低于不经回湿处理,说明回湿处理在一定程度上使膜系统受到的伤害减轻。

图3 不同处理种子的Pro含量比较
2.3 不同处理种子的Pro含量比较
受到逆境胁迫时,干旱胁迫下植物体内积累脯氨酸(Pro)具有一定普遍性,Pro可作为渗透调节物质及自由基清除剂而起保护作用,从而增强植物的抗逆性[21]。图3表明,各种子Pro含量积累趋势与发芽率较为一致,与MDA含量相反。CK2的Pro含量达到307μg·g-1,明显高出其他种子;1.17%和2.23%含水量种子的Pro含量均不到53%。这说明Pro做为一种保护性物质,起到调节细胞膜渗透平衡,从而维持种子活力的作用,而适宜的含水量有利于种子积累更多的Pro。与不经回湿处理的种子相比,室内回湿和PEG回湿种子的Pro含量都要高一些,其中室内回湿Pro含量最高。
2.4 不同处理种子的总糖含量比较
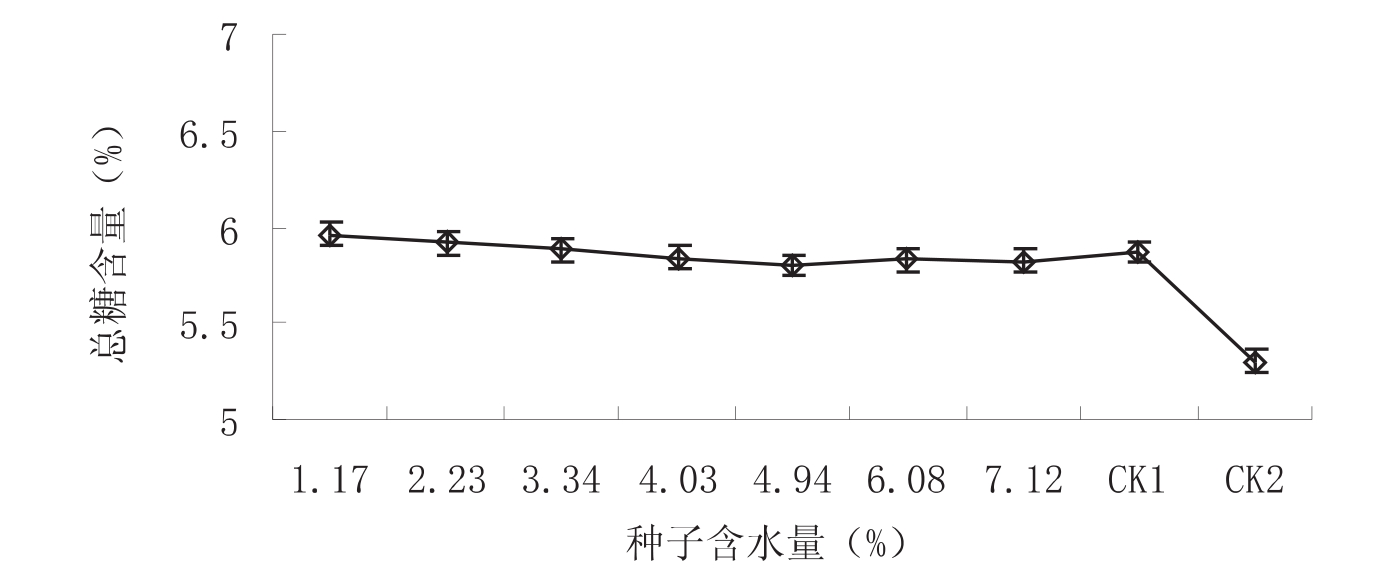
图4 不同处理种子的总糖含量比较
不同水分梯度种子和对照的总糖含量如图4所示。除CK2总糖含量较低为5.3%外,其他种子的总糖含量并无明显差别;在7个水分梯度中,随着含水量的降低,总糖含量呈增加的趋势,4.94%除外,其在7个水分梯度中总糖含量最低。以上表明种子保持较高活力可能与总糖含量降低有关。
2.5 不同处理种子的脂肪酸组分比较
表1 不同处理种子的脂肪酸组分比较(%)

3个含水量梯度种子和对照种子的脂肪酸组分比较见表1。4.94%和3.34%含水量种子与1.17%含水量种子相比,不饱和脂肪酸中的油酸含量分别高出0.28%和7.98%,亚油酸含量分别高出16.24%和11.99%,亚麻酸含量分别高出1.4%和1.48%;而饱和脂肪酸中的棕榈酸含量分别要低5.92%和8.29%,硬脂酸含量分别低4.02%和5.18%。CK2的不饱和脂肪酸含量明显高于CK1。5个处理的脂肪酸不饱和指数从高到低排序分别为4.94%、3.34%、CK2、CK1、1.17%,这与种子发芽率情况一致。说明种子活力保持与其不饱和脂肪酸的含量有一定关系,较为适宜的含水量种子在保存过程中积累了更多的不饱和脂肪酸。
3 结论
(1)本研究结果表明木豆种子较为适宜的脱水范围为4.03%~7.12%,在此范围内经过室内回湿处理其发芽率都在60%以上,保存效果优于常温保存,其中以4.94%含水量保存效果最佳,结合室内回湿处理后,其发芽率达到75%,接近于在低温保存的效果(发芽率80%)。因此,从操作性、成本等角度考虑,采用超干燥的方法保存木豆种子是可行的。
(2)不同种子耐干性差异很大,淀粉类种子很难干燥到含水量为5%以下水平,而含油量高的种子易于干燥至该水平以下,且种子活力不受影响[22]。这一观点为研究者普遍接受,国内外学者对豆类种子的超干研究结果也与此观点相符,如E llis等[23,24](1989~1990)对豌豆和绿豆的超干保存研究表明超干储藏的最适含水量均为6%;Kong等[25](1998)发现长豇豆超干储藏的最适含水量为6%;郑普英等[26](2001)的研究表明,室温下大豆种子保存的适宜含水量为5.4%~6.0%。笔者在对木豆的脱水过程中发现,当木豆脱水至含水量2.23%时,用硅胶在常温下就很难再进一步对其干燥,只有硅胶结合烘干的办法,才得到了更低的含水量梯度,这一情况也印证了淀粉类种子不易脱水至低水平的观点。但是本研究表明木豆超干储藏的最适含水量为4.94%,比上述豌豆、绿豆、长豇豆、大豆的最适含水量明显要低,这与上述传统的观点不一致。这可能是因为木豆所处生境与上述4种豆类相比更加干旱,木豆对生境产生适应性,而生境适应性使木豆种子的耐干性提高。
(3)本研究中种子脱水至不同梯度时,脯氨酸积累量有较大变化,适宜的含水量使种子积累更多的脯氨酸,脯氨酸参与细胞渗透调节使丙二醛含量降低,从而使种子保持了较高的生活力。一些报道指出[27-29],某些植物通过增加不饱和脂肪酸含量来抵御如低温、盐胁迫等逆境。不饱和脂肪酸及其衍生物在植物抗逆反应中具有调节作用,它们通过不同代谢途径形成结构各异、功能相关的一组化合物。一方面作为信号分子,控制防御相关基因的转录,调节病程相关蛋白质的表达;另一方面作为抗菌物质和愈伤物质的有效组成,提高植物的免疫能力,增强植物对伤病、虫害的抗性[30]。同时糖与脂肪酸的合成代谢途径是相互联系的,但是关于种子超干储藏中糖、脂肪酸组分变化的研究报道较少。胡小荣等[16,31](2006)的研究指出,脂肪酸总体含量的增加有利于大葱种子生活力保持,超干保存也使种子的一些糖类(如葡萄糖、果糖、蔗糖、半乳糖)产生变化。本研究发现适宜的含水量保存使种子的脂肪酸不饱和指数增加,不饱和脂肪酸含量的增加有利于种子活力保持。研究中总糖含量的下降可能与合成脂肪酸有关。
(4)由于试验中种子保存时间尚短,有待于进一步增加保存年限来对木豆种子超干保存进行研究。采用经过超干保存的种子开展定点栽培试验,观察植物是否产生了形态变异,并且通过分子标记等手段来检验超干种子的基因型是否稳定。
参考文献
[1]Nene Y J,Hall S D,Sheila V K.The pigeonpea[M].UK,CAB International,1990.
[2]Zhou C-H,Li Z-H,Saxena K B,Zhang J-Y,Gu Y,Yang S-Y,Zong X-X.Traditional and alternative uses of pigeonpea inChina[J].IntChickpea and Pigeonpea Newsletter,2001,8:55-58.
[3]Yang S-Y,PangW,ZongX-X,LiZ-H,Zhou C-H,SaxenaK B,LiangH-C.Pigeonpea:a potential fodder crop forGuangxi province ofChina[J].IntChickpea and Pigeonpea Newsletter,2001,8:54-55.
[4]郑元元,杨京,陈迪华,等.木豆叶芪类提取物对雌激素缺乏性大鼠骨质丢失的影响[J].药学学报,2007,42(5):562-565.
[5]Lin L,Xie N,Cheng ZH.Flavonoids from Cajanus cajan L.[J].J China Pharm Univ(中国药科大学学报),1999,30:21-23.
[6]郑元元,杨京,陈迪华,等.木豆叶提取物对人的类成骨细胞TE85成骨功能和体外破骨细胞分化的影响[J].药学学报,2007,42(4):386~391.
[7]付玉杰,孔羽,刘威,等.木豆种子萌发和幼苗生长过程中的芹菜素与木犀草素含量变化[J].植物生理学通讯,2006,42(5):951~954.
[8]刘锦春,钟章成,何跃军.重庆石灰岩地区木豆与十大功劳叶片气体交换的比较[J].生态学报,2006,26(9):2964-2970.
[9]W hiteman P C,Norton BW.A lternative uses for pigeonea.In:Proceeding of the InternationalWorkshop on pigeonea Volume[M].India:ICRISAT Center,1980:365~370.
[10]拜得珍,纪中华,沙毓沧.元谋干热区两年生木豆(Cajanus cajan)人工林营养循环和养分利用效率[J].生态学报,2007,27(3):1093-1098.
[11]张建云,李正红,刘秀贤,等.木豆籽实贮存辐射防虫的研究[J].林业科学研究,2001,14(5):582-586.
[12]EllisR H,Hong T D,RobertsE H.The low moisture content limit to the negative logarithmic relation between seed Iongevity and moisture content in three subspecies of rice[J].Annals ofBotany,1992,69(4):53-58.
[13]EllisR H,Hong T D,Desiccation tolerance and potential longevity of developing seeds of rice(Oryza sativa L.)[J].Annals ofBotany,I994,73(1):501-506.
[14]ZhengG H,Jing X M,Tao K L.U ltradry storage cuts cost of gene bank[J].Nature,1998,393:223-224.
[15]宋松泉,程红炎,龙春林,等.种子生物学研究指南[M].北京:科学出版社,2005:57-59.
[16]胡小荣,陶梅,卢新雄,等.不同含水量大葱种子储藏过程中的糖代谢研究[J].植物遗传资源学报,2006,7(1):85-88.
[17]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2003:258-261.
[18]郭逍宇,董志,宫辉力.再生水对作物种子萌发、幼苗生长及抗氧化系统的影响[J].环境科学学报,2006,26(8):1337-1342.
[19]梁炫强,潘瑞炽,周桂元,等.活性氧及膜质过氧化与花生抗黄曲霉侵染的关系[J].中国油料作物学报,2002,24(4):19-23.
[20]孙文越,王辉.外来甜菜对干旱胁迫下小麦幼苗膜质过氧化作用的影响[J].西北植物学报,2001,21(3):487-491.
[21]YamadaM,Morishita H,Urano K,et a1.Effects of free proline accumulation in petunias under drought stress.J Exp Bot,2005,56(417):1975-1981.
[22]汪晓峰,景新明,郑光华.含水量对种子储藏寿命的影响[J].植物学报,2001,43(6):551-557.
[23]EllisR H,Hong T D,RobertsE H.A comparison of the low-moisture-content limit to the logarithmic relationship between seed moisture and Iongevity in twelve species[J].Ann Bot,1989,63:601-611.
[24]EllisR H,Hong T D,Roberts E H.A low-moisture-content limit to relationships between seed moisture and Iongevity[J].Ann Bot,1990,65:493-504.
[25]Kong X H,Zhang H Y.The effect of ultradrymethods and storage on vegetable seeds[J].Seed SciRes,1998,8(Suppl.1):41-45.
[26]郑普英,伍晓明,黄永菊,等.大豆种子超干燥保存研究[J].中国油料作物学报,2001,23(1):22-26.
[27]赵福庚,束怀瑞.脂肪酸对盐胁迫大麦根系质膜结合多胺含量和膜上Na+/H+逆向运输的影响[J].科学通报,2002,47(8):608-612.
[28]赵新西,马千全,梁超,等.甜菜碱预处理对盐胁迫下小麦幼苗类囊体膜脂脂肪酸组分和功能的影响[J].作物学报,2006,32(5):703-708.
[29]OrvilleM Lindstrom.The use of leaf parts to estimate the cold hardiness of southernMagnolia(Magnolia grandi flora L.)[J].Hortscience,1992,27(3):247-249.
[30]Weber H.Fatty acid-derived signals in plants.[J].Trends PlantSci.,2002,7:217-224.
[31]胡小荣,陶梅,卢新雄,等.不同含水量大葱种子贮藏后的脂肪酸代谢研究[J].植物遗传资源学报,2006,7(4):464-467.
Selection ofOptimum Moisture Content and Mechanism ofCajanus cajan Seeds for U ltradry Storage
CUI Kai1,LI Kun1,2,LI Li1,SUN Yong-yu1
(1.Research Institute ofResources Insects,CAF Kunming 650224; 2.Yuanmou DesertEcosystem Research Station of the State Forestry Administration,Kunming 650224)
Abstract:Cajanus cajan Seeds were dried to differentmoisture contents ranging from 1.17%to 7.12%,then stored at room temperature for 12 months.The germinability,proline(Pro)content,malondialdehyde(MDA)content,total sugar content and fatty acid composition of the seedswere studied combined with different treatments of humidification.The results showed that the feasiblemoisture contentof seed was ranging from 4.03%to7.12%.In this range,the germinability of seedswas higher than the seeds stored at room temperaturewith normalmoisture content,which germination ratewas above60%.Meanwhile,the optimum moisture content of seedswas4.94%,which the germination rate of seedswas75% combined with humidification.The results ofmeasuring the 4 physiological and biochemical indexes indicated that as the seeds with the appropriatemoisture content and treatment of humidification,the Pro content and index of unsaturated fatty acid were increased,the total sugar contentwas decreased,and themembrane peroxidation of seedswas lightened,which the seeds kept the better vigor.
Key words:Cajanus cajan Seeds;ultradry Storage;membrane peroxidation;fatty acid composition
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















