三、补体系统的激活
在生理情况下,补体各成分以酶原或非活性形式存在于体液中,只有在某些激活物作用下或在特定的固相表面上,补体各成分则按一定顺序,以连锁的酶促反应方式依次被激活,表现出多种生物学效应。
补体激活的三条途径(图3-11)具有共同末端通路,即形成膜攻击复合物(membrane attack complex,MAC)。
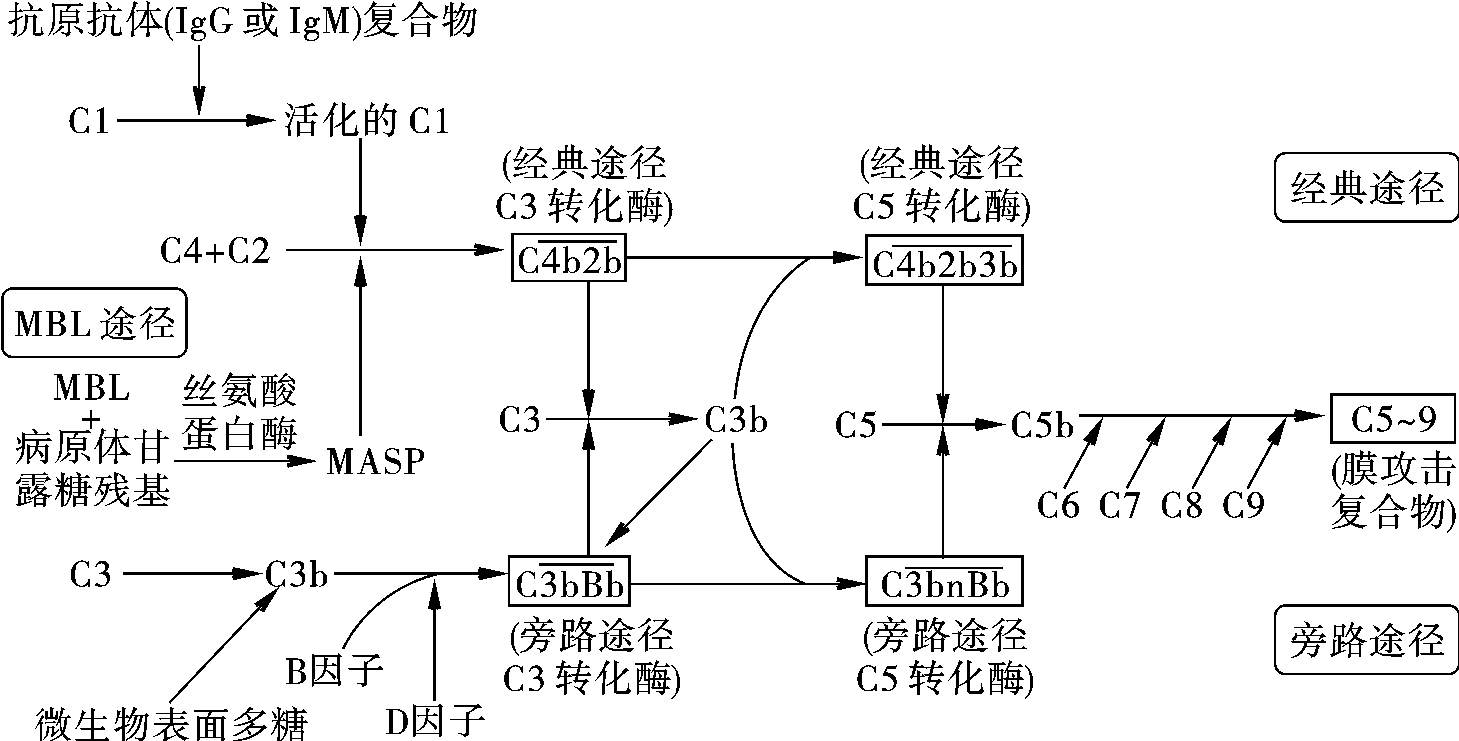
图3-11 补体激活途径示意
(一)经典激活途径
1.激活物 抗原与抗体(IgM、IgG3、IgG1、IgG2)结合形成的免疫复合物(immune complex,IC)是经典途径的主要激活物。首先激活C1,然后依次激活其他补体固有成分。C1是由一个C1q分子借助于Ca2+与两个C1r和两个C1s分子结合组成的多聚体;C1q由6个亚单位聚合而成(图3-12),其中每一亚单位的球形头部是C1q与抗体结合的部位,一个C1q必须同时有两个以上的球形头部与抗体结合后才能被激活。因此两个以上IgG的Fc段补体结合点与C1q结合方可激活补体,单个IgM与C1q结合后即可激活补体。
2.激活过程 参与补体经典激活途径的补体成分包括C1~C9。此过程分为识别阶段、活化阶段和膜攻击阶段。

图3-12 C1分子结构示意
(1)识别阶段 即C1识别IC而活化形成C1酯酶的阶段。IgG或IgM与抗原结合后,其Fc段构象发生改变,暴露出Clq补体结合点(CH2/CH3),Clq与之结合。当两个以上C1q头部被IC中IgG或IgM的Fc段结合固定后,C1q的6个亚单位的构象发生改变,在Ca2+参与下,导致C1r被裂解,形成的小片段即为激活的C1r。活化的C1r继续激活C1s,活化的C1s为C1酯酶,可激活C4和C2。
(2)活化阶段 为C3转化酶和C5转化酶的形成阶段。C1酯酶在Mg2+参与下,依次裂解C4、C2,所产生的小片段C4a、C2a释放入液相,而大片段C4b、C2b两者结合在黏附有抗体的靶细胞膜上,形成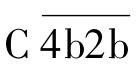 ,即为C3转化酶。
,即为C3转化酶。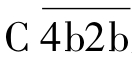 裂解C3,产生C3a和C3b。C3a释放入液相,C3b与靶细胞膜上的
裂解C3,产生C3a和C3b。C3a释放入液相,C3b与靶细胞膜上的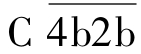 结合,形成
结合,形成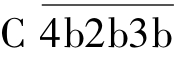 复合物,即为C5转化酶。
复合物,即为C5转化酶。
(3)膜攻击阶段 为MAC的形成,导致靶细胞溶解的阶段。C5转化酶裂解C5为C5a和C5b,C5a进入液相,C5b吸附于靶细胞表面,先后与C6、C7结合,形成C5b67复合物。C5b67复合物插入靶细胞浆膜脂质双层中,进而与C8呈高亲和力结合,形成C5b678,该复合物可牢固地附着于细胞表面,细胞膜上可出现裂痕,但其溶细胞能力有限。C8是C9的结合部位,12~15个C9与C5b678结合成C5b6789复合物,即MAC,嵌入靶细胞脂质双层,形成无数个小孔,可使水和电解质自由出入,细胞内渗透压改变,细胞肿胀并破裂溶解。
(二)MBL激活途径
MBL激活途径是由急性期蛋白与细菌的甘露糖残基结合后启动的激活过程。在病原微生物感染早期,体内单核-巨噬细胞和中性粒细胞可产生TNF-α、IL-1和IL-6等细胞因子,导致机体发生急性炎症,并诱导肝细胞合成、分泌急性期蛋白,如参与补体激活的MBL和C反应蛋白。MBL首先与细菌的甘露糖残基结合,随后激活与之相连的丝氨酸蛋白酶,形成MASP。MASP具有与活化的C1q类似的生物学活性,可水解C4和C2分子,继而形成C3转化酶,其后的反应过程与经典途径相同。此外,C反应蛋白也可与C1q结合并使之激活,然后依次激活补体其他成分。
(三)旁路激活途径
旁路激活途径又称替代途径或C3激活途径。此过程越过C1、C4、C2,直接激活C3,然后完成C5~C9的激活。B因子、D因子和P因子参与激活过程。
1.激活物 旁路途径的激活物质主要是细菌细胞壁成分(LPS、肽聚糖、磷壁酸)、酵母多糖以及凝聚的IgA和IgG4。上述成分实际上是提供了使补体活化级联反应得以进行的接触表面。这种激活方式可不依赖于特异性抗体的形成,从而在感染早期为机体提供有效的防御机制。
2.激活过程 C3是激活旁路途径的关键。经典途径中产生或自发产生的C3b在Mg2+参与下可与B因子结合形成C3bB,血清中D因子继而将结合状态的B因子裂解成Ba和Bb。Ba释放入液相,Bb仍附着于C3b并与之结合,所形成的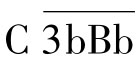 复合物即为旁路途径的C3转化酶,其中的Bb片段具有蛋白酶活性,可裂解C3。C3转化酶极不稳定,可被迅速降解,血清中的P因子(备解素)可与之结合,使之稳定,并形成
复合物即为旁路途径的C3转化酶,其中的Bb片段具有蛋白酶活性,可裂解C3。C3转化酶极不稳定,可被迅速降解,血清中的P因子(备解素)可与之结合,使之稳定,并形成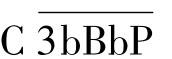 。C3转化酶水解C3生成C3a和C3b,后者沉积在颗粒表面并与
。C3转化酶水解C3生成C3a和C3b,后者沉积在颗粒表面并与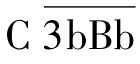 结合形成
结合形成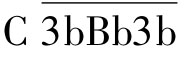 或C
或C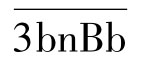 ,即C5转化酶,其功能与经典途径的C5转化酶
,即C5转化酶,其功能与经典途径的C5转化酶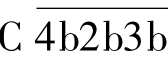 类似,能够裂解C5,引起相同的末端效应。在此过程中C3b既是C3转化酶的成分,又是C3转化酶的作用底物,可裂解更多的C3,产生更多的C3b,形成更多的C3转化酶,对旁路途径及经典途径形成正反馈放大效应。上述三条途径虽起点各异,但相互交叉都以C3活化为中心,具有共同的末端反应过程。三条途径的比较见表3-5。
类似,能够裂解C5,引起相同的末端效应。在此过程中C3b既是C3转化酶的成分,又是C3转化酶的作用底物,可裂解更多的C3,产生更多的C3b,形成更多的C3转化酶,对旁路途径及经典途径形成正反馈放大效应。上述三条途径虽起点各异,但相互交叉都以C3活化为中心,具有共同的末端反应过程。三条途径的比较见表3-5。
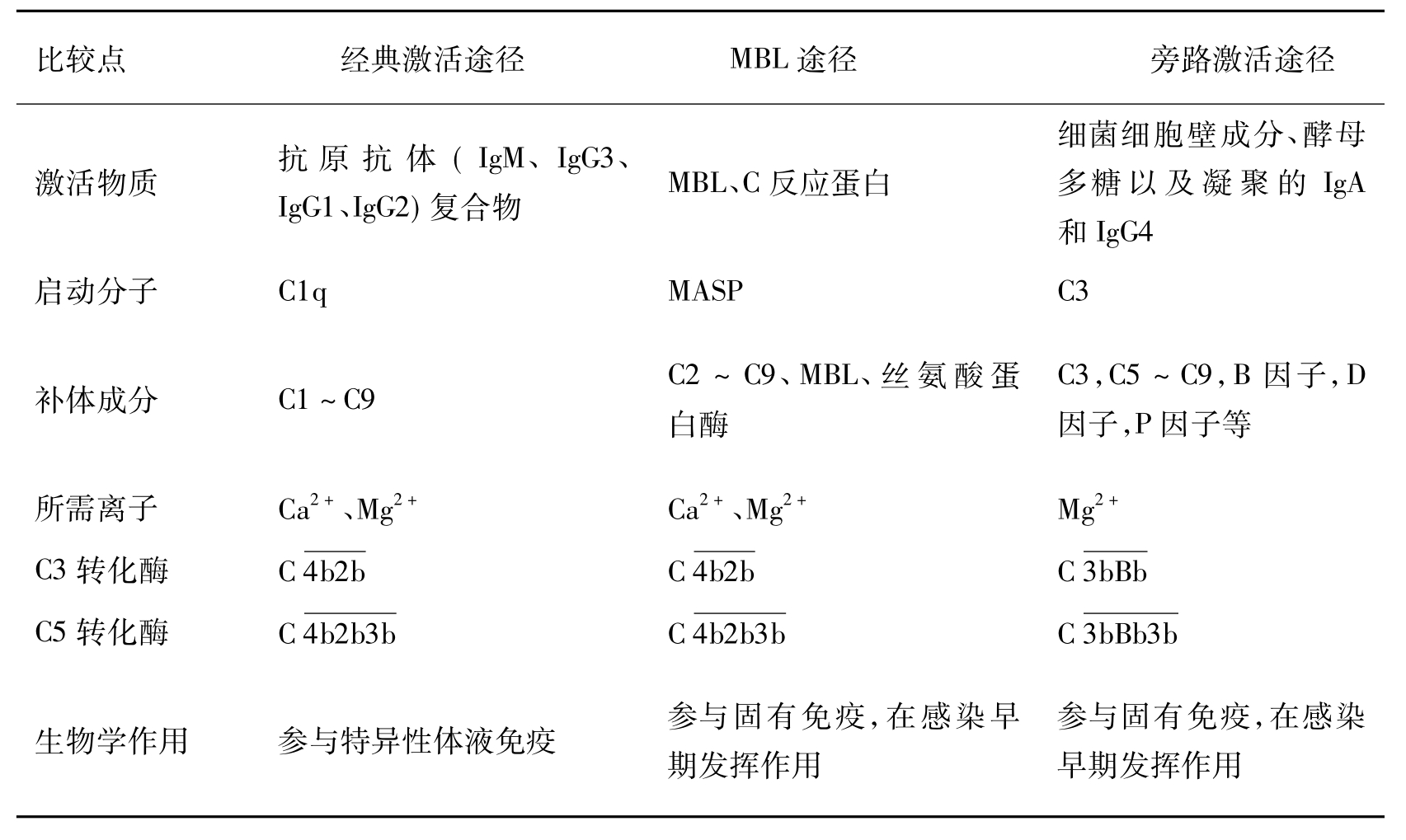
表3-5 补体三条激活途径的比较
(四)补体激活的调节
补体活化是一种高度有序的级联反应,机体通过一系列的复杂的因素,调节补体系统的激活过程,使之反应适度。补体系统若过度激活,不仅消耗大量补体成分,使机体抗感染能力下降,而且在激活过程中产生的大量活性物质,会使机体发生剧烈的炎症反应或对自身组织细胞造成损伤,引起病理过程。机体通过多种机制调节补体系统的激活过程,包括补体自身衰变调控及补体调节蛋白的作用,从而有效的维持机体的自稳功能。
1.自身衰变的调节 补体激活过程中产生的某些裂解产物极不稳定,易于自行衰变,不再继续激活后续补体成分,成为补体激活过程中的一种自控机制,如C4b、C2b、C3转化酶、C3b、C5转化酶、C5b。
2.调节蛋白的调节 可溶性的C4bP、C1INH、I因子、H因子等对C1s、C4b、C3b和C 3bBb等具有灭活作用;膜辅助蛋白(MCP)、衰变加速因子(DAF)等存在于免疫细胞上,对结合在自身细胞表面的活性片段具有灭活作用。因此,补体调节因子可与不同补体成分相互作用,使补体的激活与抑制处于精细的平衡状态,既可防止对自身组织损伤,又能有效地杀灭病原微生物。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















