[目的] 建立切实可行的内部质量管理监控工作流程,从而保证对临床试验的全过程进行监控管理,确保临床试验能够顺利实施。
[适用范围] 所有临床试验。
[规程]
Ⅰ期药物临床试验的质量控制由Ⅰ期临床试验研究室的负责人、具有高级职称的医师或药剂师实施。并按以下程序进行。
1.受试者知情同意的质量控制 在知情同意书签署后,抽取20%受试者,询问受试者对所参加的临床研究是否知情、对知情同意书所述内容是否知晓。
(1)知晓,则本步骤的质量控制获得通过。
(2)部分知晓或完全不知晓,则要求执行知情同意的医师再次对所有受试者进行宣教和沟通,然后抽取40%受试者再次询问。知晓则获得通过,部分知晓或完全不知晓则重复本步骤。
2.受试者入组的质量控制 检查所有受试者的检查结果,是否符合入组标准。
(1)符合标准者,则本步骤的质量控制获得通过。
(2)不符合者,则分析原因,提出是否复查相关检查项目,最终确定入组或排除。
3.药品管理的质量控制 药品的验收、发放、回收,必须双签字,并有完整数量清点记录。
药品按照规定的条件储存,必须每日记录温、湿度。专人、专柜,加锁管理。定期检查有效期。
(1)符合规定,则本步骤的质量控制获得通过。
(2)不符合者,则分析原因,提出整改意见;若药品失效,则更换药品;追究药品保管人员的责任。
4.样品采集的质量控制 样品采集时,每组必须由2人同时操作,其一为护理人员,负责抽血等工作,另一人负责监督并记录。将监督结果记载于“样品采集记录表”中。要求采血时间点的误差区间,原则上在该点前后两点时间间隔的±5%之内。在“样品采集记录表”中,抽查20%受试者的记录,是否符合误差控制。
(1)抽查合格,并操作人员报自查合格,则本步骤的质量控制获得通过。
(2)不合格者
①查找采血时间不准的原因,提出改进措施。
②采血的监督记录人员,在采血结束后分析整个采血情况,标明超出误差控制的采血时间点。将超出采血时间误差控制的受试者和采血点报I期临床试验研究室。
③在以后数据处理和统计分析中,将此受试者的数据特殊标出。根据具体情况进行数据分析或单独处理该受试者的数据。
5.试验结束后,受试者查体的质量控制 在试验的临床部分结束后,受试者必须进行全面的体检,在确保受试者无异常时,可以让其离院。对受试者进行体检的医师必须将所有超出正常范围的体检结果报上级医师。判断后由研究负责人做以下决定。
(1)不允许受试者离院。
(2)允许受试者离院但须随访。
(3)允许离院。
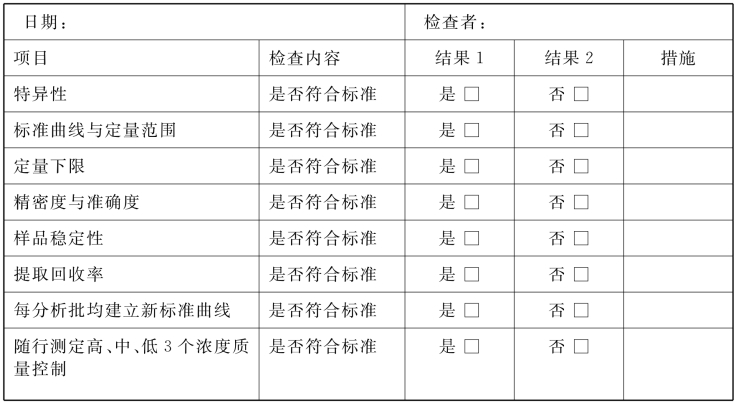
6.生物样品分析方法及样品检测的质量控制 生物样品分析方法及样品检测开始前须由试验人员提交试验进度表,质控人员根据试验进度在每个阶段进行相应检查。符合以下标准则通过质量检查,不符合则须重复实验操作,并做记录。
(1)特异性:色谱法至少考察6个不同个体的空白生物样品色谱图、空白生物样品外加对照物质色谱图(注明浓度)及用药后的生物样品色谱图。
(2)标准曲线与定量范围:至少用6个浓度建标准曲线。各浓度点的实测值与标示值之间的偏差在可接受的范围之内,制定标准曲线合格。可接受范围一般规定为,最低浓度点的偏差在±20%以内,其余浓度点的偏差在±15%以内。
(3)定量下限(lower limit of quantitation,LLOQ):LLOQ应能满足测定3~5个消除半衰期时样品中的药物浓度,或能检测出Cmax的1/10~1/20的药物浓度。
(4)精密度与准确度:精密度通常用质控样品的日内和日间相对标准差(relative standard deviation,RSD)来考察,一般RSD应小于15%,LLOQ附近小于20%。准确度一般应在85%~115%范围内,LLOQ附近应在80%~120%范围内。
(5)样品稳定性:根据具体情况,对含药生物样品在室温、冰冻或冻融条件下以及不同存放时间进行稳定性考察。
(6)提取回收率:考察高、中、低3个浓度的提取回收率,其结果应精密并具有可重现性。
(7)每个分析批生物样品测定时建立新的标准曲线,并随行测定高、中、低三个浓度的质控样品:质控样品测定结果的偏差一般应小于15%,低浓度点偏差一般应小于20%。最多允许1/3的质控样品结果超限,但不能出现在同一浓度样品中。
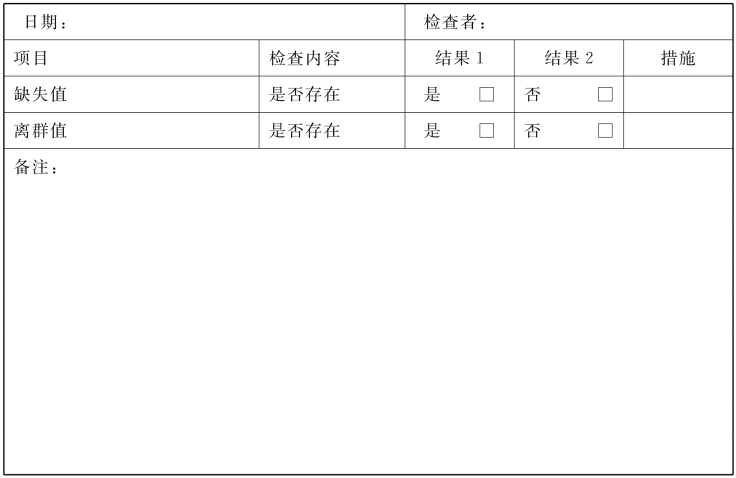
7.统计分析的质量控制
(1)缺失值:病例报告表中原则上不能有缺失值,尤其是重要指标(主要的安全性指标)必须填写清楚。基本数据,如性别、出生日期、入组日期和各种观察日期等不得缺失。试验中观察的阴性结果、测得的结果为零和未能测出者,均应有相应的符号表示,不能空缺,以便与缺失值相区分。如果出现缺失值,应先查找原始资料,确定是否漏填,如确为漏填应补填;如原始资料中无记录,而该缺失值是涉及安全性的重要指标,则应通知受试者立即复查,以确保其安全;如缺失值影响结果判定,则该病例剔除。
(2)离群值:应当从医学、药学和统计学方面去判断,尤其应从医学和药学专业知识判断。对于生化指标的离群值,应从医学专业知识判断其是否有意义,并对受试者做相应处理。对于样品检测指标的离群值,应重复进行检测,判断是否由于操作误差引起。
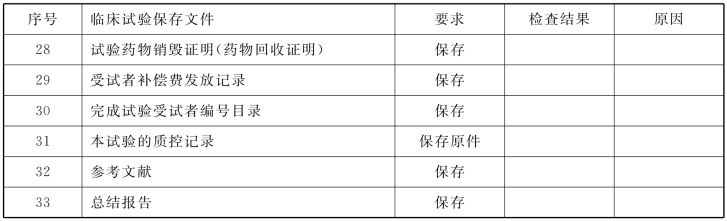
8.数据管理质量控制 按GCD附录2中必须保存的文件清单,逐条核对。如有缺项,则要求相关人员补齐。
附件 Ⅰ期临床试验的内部质量控制流程记录表。
附件
Ⅰ期临床试验的内部质量控制流程记录表
项目编号:
1.受试者知情同意的质量控制 在知情同意书签署后,抽取20%受试者,询问其对所参加的研究是否知情、对知情同意书所述内容是否知晓。

2.受试者入组的质量控制 复核所有受试者的检查结果,是否符合入组标准。

3.药品管理的质量控制 药品的验收、发放、回收,必须双签字,并有完整数量清点记录。
药品按照规定的条件储存,必须每日记录温、湿度。专人、专柜,加锁管理。定期检查效期。

4.样品采集的质量控制 样品采集时,每组必须由2人同时操作,其一为护理人员,负责抽血等工作,另一人负责监督并记录。将监督结果记载于“样品采集记录表”中。要求采血时间点的误差区间,原则上在该点前后两点时间间隔的±5%之内。在“样品采集记录表”中,抽查20%受试者的记录,是否符合误差控制。
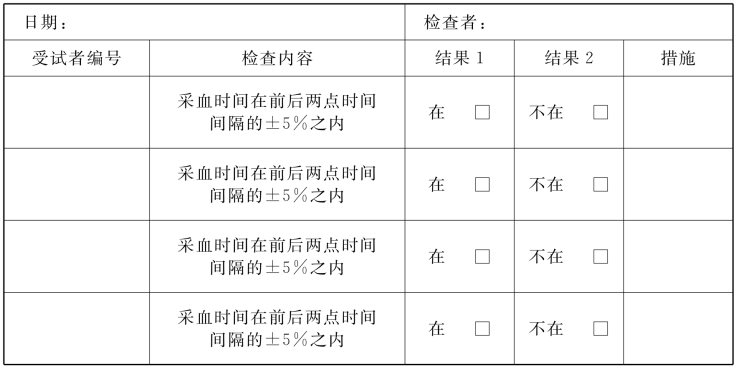
5.试验结束后,受试者查体的质量控制 在试验的临床部分结束后,受试者必须进行全面的体检,在确保受试者无异常时,可以让其离院。对受试者进行体检的医师必须将所有超出正常范围的体检结果报上级医师。并由研究项目负责人做以下决定。
A.不允许受试者离院; B.允许受试者离院但须随访; C.允许离院。

6.生物样品分析方法及样品检测的质量控制 生物样品分析方法及样品检测开始前须由试验人员提交试验进度表,质控人员根据试验进度在每个阶段进行相应检查。
7.统计分析的质量控制 质控人员检查统计分析的过程中是否出现缺失值及离群值,根据实际情况提出相应的解决办法。
8.数据管理质量控制 按《药物临床试验质量管理规范》(GCP)附录2中必须保存的文件清单,逐条核对。如有缺项,则要求相关人员补齐。

日期: 检查者:
9.数据管理质控检查表
(1)临床试验准备阶段

(2)临床试验进行阶段

(3)临床试验完成后
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















