精练·探究·反思·赏析——生本理念下高三化学“双水解”复习教学案例
肇庆市第一中学 邱伟兴
一、问题的提出
传统的高三化学复习的模式是教师讲,学生听,学生做。教师通常越俎代庖,没有给学生探究的机会。教学实践证明,这种教学模式和方法所产生的效益是微乎其微的。为改变这种模式,探讨有效的高三化学备考复习模式,我于2008年11月承担了全市性的一节公开课,运用生本的理念,充分利用学生资源,挖掘学生的潜能,调动学生的主观能动性,让学生自主探究知识。学生先“练”,教师后“教”,把学习的主动权交还给学生,让学生参与知识的发生、发展与形成过程,让学生自己学会学习;运用“精练、探究、反思”等多种教学方法,培养学生良好的学习方法和创新精神;把向学生传授知识的做法转变为积极引导学生探索知识。
二、教学流程
(一)精练
精心遴选练习题,激发学生的学习兴趣。所选的练习题包括基础题、趣味题、高考题和信息题。我事先将试题印发给学生,让学生有足够的时间进行思考、交流与讨论,在正式上课时用投影机显示出来。题目如下:
(1)Al3+与S2-、H2O反应的离子方程式为_________________________。
(2)Fe3+与S2-、H2O反应的离子方程式为_________________________。
(3)选择制备盐的途径:要制备Al2S3,应采用________方法,其理由是____。
(4)判断离子能否大量共存:Al3+、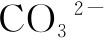 在溶液中不能大量共存的原因是______。
在溶液中不能大量共存的原因是______。
(5)泡沫灭火器是常用的灭火器,它由内、外两个筒组成,内筒为塑料筒,盛有硫酸铝溶液,外筒和内筒之间装有碳酸氢钠溶液,使用时将灭火器倒置,两种溶液混合即发生剧烈反应,产生大量泡沫从而达到灭火效果。你能试着解释其中的原理吗?_____________。
(6)ICl的化学性质跟Cl2相似,预计它跟水反应的最初生成物是_____________。
(7)Mg3N2与H2O反应的化学方程式是_________________________。
完成练习后,由各学习小组相互点评,学生的热情高涨,教师关注每一组同学的点评情况。
甲组:乙组的同学做的(1)题中离子方程式不配平,漏写“↑”、“↓”,“══”与“ ”使用混淆;(2)题中出现两组写法:①2Fe3++S2-══S↓+2Fe2+;②2Fe3++3S2-
”使用混淆;(2)题中出现两组写法:①2Fe3++S2-══S↓+2Fe2+;②2Fe3++3S2-
══Fe2S3↓,不知哪种写法对?请老师裁决;(3)题中答对了方法,但陈述理由时不到位;(4)题答到点子上,很好!
乙组:甲组的同学做的(5)题基本答对了;(6)题写成了HCl和HIO;(7)题写对了。
经过一番激烈“较量”,学生在练习中存在的问题得到了充分暴露,但有些问题仍无法解决,怎么办?
(二)探究
学生之间经过反复讨论而仍未解决的问题,通过师生的互动,开展实验探究是解决问题的最佳方法。如(2)题,哪种对,为什么会这样,与什么因素有关?有学生提出:会不会与反应的介质有关,如果是这样,可设计在酸性、中性、碱性介质中,通过探究实验方法便可得出结论。方案如下:C(Fe3+)与C(S2-)在酸性、中性和碱性介质的反应。
探究实验1:试管+10mL0.2mol/LFeCl3(FeCl3溶液过量,溶液呈酸性)+5mL0。2mol/LNa2S 现象?
现象?
探究实验2:试管+5mL0.2mol/LFeCl3+10mL0.2mol/LNa2S(Na2S溶液过量,溶液呈碱性) 现象?
现象?
探究实验3:向盛有5mL0.2mol/LFeCl3溶液的试管中,逐滴滴入0.2mol/LNa2S溶液至中性 现象?
现象?
教师设问:上述实验各有什么现象?
各实验小组回答实验结果:在酸性介质中产生浅黄色沉淀,并有极少量的气体产生;在中性和碱性介质中产生黄绿色沉淀。
教师设问:为什么会产生上述实验现象?
丙组与丁组PK后,最终达成产生上述现象的原因是:Fe3+具有较强的氧化性,而S2-则具有还原性,因此当Fe3+与S2-相遇时,Fe3+能将S2-氧化成S,而自身被还原为Fe2+,即发生反应:2Fe3++S══2-2Fe2++S↓。Fe3+在酸性条件下,其氧化性要比在碱性条件下强,在Fe3+与S2-反应中,应发生上述反应;溶液呈碱性或中性,此时Fe3+氧化性减弱,Fe3+和S2-会结合成溶解度极小的Fe2S3沉淀,即2Fe3++3S══2-Fe2S3↓。所以,Fe3+与S2-反应要看介质环境。
此时,学生报以热烈的掌声,印象非常深刻。
(三)反思
教师:历史使人睿智,反思使人进步。通过反思进行自我诊断,使我们的思维过程进行自我监控和自我调节。本节课可以反思的内容有多种,如对双水解的概念、规律和应用进行反思,对书写双水解离子方程式方法、思路、策略以及由双水解延伸出来的问题进行反思等。
投影显示出学生反思的问题:
(1)双水解的概念是什么?
(2)哪些离子会发生双水解反应,有什么规律?
(3)某些共价化合物[如ICl、问题(6)]、离子型的碳化物会发生双水解吗?
(4)怎样书写双水解的离子方程式?
(5)双水解反应能否完全进行决定于哪些因素?
讨论与交流:
学生甲:(1)弱酸根离子与弱碱阳离子在水溶液中互相促进水解,水解程度增大,水解反应能完全进行(俗称“双水解反应”)。
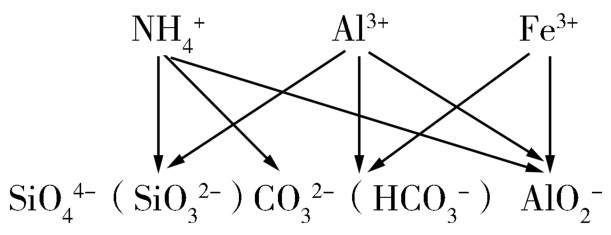
学生乙:(2)弱酸根离子与弱碱阳离子在水溶液发生双水解反应,一般的规律是:连线上的两种物质均可发生双水解反应。
学生丙:(3)ICl是化合物,I元素为+1价,Cl元素为-1价,与水反应实际上是化合价不变的水解(复分解)反应。所以,ICl和H2O反应生成HCl和HIO。
学生丁:(3)还可以结合下式来帮助理解:
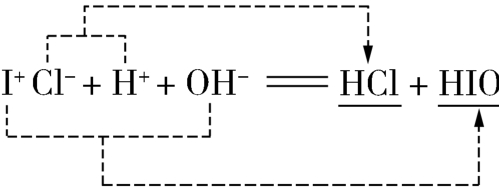 (I+与OH-结合不会是IOH,而是HIO。)
(I+与OH-结合不会是IOH,而是HIO。)
进一步扩展:离子型碳化物CaC2、Al4C3、ZnC2、Mg2C3以及能发生双水解反应的物质(如Al2S3)分别与水反应的化学方程式也可以这样理解。(说毕,全场又一次响起热烈的掌声。)
学生戊:(4)如:AlCl3溶液与Na2S溶液混合后的离子方程式:
首先判断产物:Al3+水解到底生成Al(OH)3,S2-水解到底生成H2S,然后确定两种离子系数比。因为生成物都是中性物质,所以发生双水解反应的两种离子所带电荷应相等,即Al3+与S2-按2∶3反应,所以离子方程式为:2Al3++3S2-+3H2══O2Al(OH)3↓+3CO2↑。
学生己:①互相促进水解程度大小(包括物质本性、外界条件等的影响);②水解产物的溶解度。
(四)赏析高考试题
展示高考试题,让学生“品味”双水解反应这一考点在高考试题中的体现。
思考与交流:[2008年广东高考23题(3)]硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释:__________。
三、课后反思
1.本节复习课改变了以往高三复习课“满堂灌”的复习模式,是运用“生本理念”进行复习教学的大胆尝试。
2.在整个课堂上利用精练、讨论、交流、学生互评、实验探究、PK等多种形式,最大限度地发挥学生的主观能动性和生生参与的协作精神,教师只起“助学”作用。
3.学生通过反思,对本节课的内容认识得更深刻,理解得更透彻。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















