
上述两个式子在热力学状态函数的推导和证明中有着广泛的应用。
3.状态函数的归一化关系式(循环关系式)

将等式右方的偏微商移至左方,得:
![]()
上式称为状态函数的归一化关系式,或称循环关系式(Euler's Chain Relation)。用它可作为判断函数Z是状态函数的充分必要条件。
如系统的状态函数p、 V、 T可通过状态方程式p =f(T, V)而联系,则其归一化关系式可表示为:

这种方法,通常称为全微分表达式法。

在温度T一定时,将上式对V求偏微商,得:
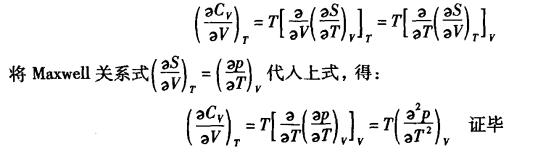
思考题
1.可逆过程的特点是什么?它与不可逆过程有什么不同?下列过程中哪些是可逆的?哪些是不可逆的?
(1)在101.3kpa及100℃条件下,水蒸气凝结为水;
(2)热量从高温物体传递给低温物体;
(3)用打气泵将空气打入轮胎;
(4)一滴红墨水在一杯清水中扩散。
2.下列公式各应用于什么条件下?
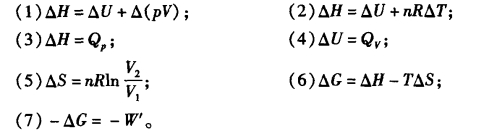
3.判断下列过程中W、 Q、 ΔU和ΔH各量是正、零还是负值:
(1)理想气体恒温自由膨胀;
(2)理想气体绝热反抗恒外压膨胀;
(3)理想气体恒温可逆膨胀;
(4)1mol实际气体恒容升温;
![]()
(6)理想气体节流膨胀;
![]()
4.进行下列过程时,ΔU, ΔH, ΔS, ΔA及ΔG何者为零?
(1)非理想气体的卡诺循环;
(2)孤立体系的任意过程;
(3)封闭体系的节流过程;
![]()
(5)理想气体的绝热可逆过程;

6.判断下列系统的熵变(ΔS)是大于零、等于零,还是小于零?
(1)理想气体恒温可逆膨胀过程;
(2)理想气体绝热可逆压缩过程;
![]()
(4)在恒温恒压下,浓硫酸溶于水(该过程大量放热)。
习 题

(1)恒温可逆膨胀;
(2)向真空自由膨胀;
(3)向外压恒定为气体终态的压力下膨胀;

试比较这四个过程的功;并说明比较的结果。
2—3某蓄电池端电压为12V,在输出电流强度为10A的情况下工作2h,这时蓄电池的热力学能减少了1265kJ。试求此过程中蓄电池的热量交换是多少?
(答:Q=-401.0kJ)



(答:Q =43.6kJ; W=-5.99kJ; ΔU=35.6kJ; ΔH=4.06 × 104J)

(答:功率为59·3W)


免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















