实验12 石灰石中钙含量的测定
实验目的
(1)掌握高锰酸钾法测定石灰石中钙含量的原理和方法;
(2)学习沉淀分离的基本知识和掌握沉淀、过滤及洗涤等操作。
实验原理
石灰石是工业生产中重要的原材料之一。石灰石中钙含量的测定主要采用配位滴定法和高锰酸钾法。前者比较简便,但干扰也较多;后者干扰少,准确度高,但较费时。本实验采用高锰酸钾法。首先将试样溶解,然后将Ca2+沉淀为CaC2O4,将沉淀滤出并洗净后,用稀H2SO4溶液溶解,再用KMnO4标准溶液滴定C2O42-,根据所消耗的KMnO4标准溶液的体积计算出试样中钙的含量。主要反应为
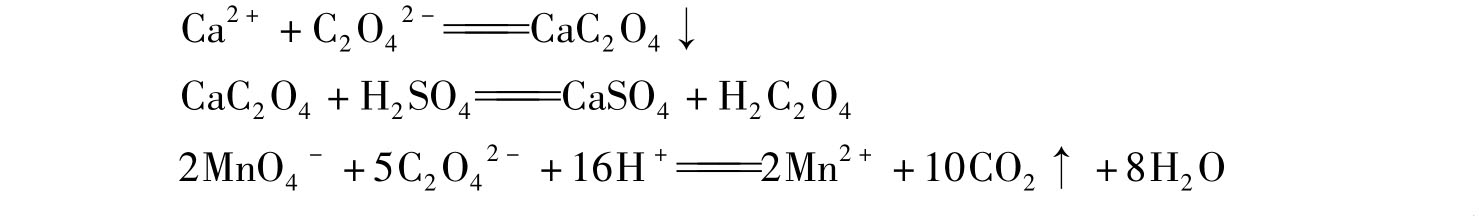
若石灰石中硅含量很低,其中的Ca可被HCl分解完全。而大多数石灰石中都有一部分Ca以硅酸盐形式存在,不能被HCl完全分解。因此石灰石的分解通常是采用碱式熔剂熔融的方法制成试液,分离除去SiO2和Fe3+、Al3+后,再测定钙,但手续较繁。本实验选用含硅量很低的石灰石试样,直接用盐酸溶解制成试样液。
为使测定结果准确,要采取以下措施。
(1)要得到Ca2+与C2O42-之间1∶1的计量关系,应使试液酸度控制在pH=4,因为酸度高时CaC2O4沉淀不完全,酸度低则会有Ca(OH)2或碱式草酸钙沉淀产生。
(2)要得到颗粒较大、便于洗涤的沉淀,可采用在酸性溶液中加入(NH4)2C2O4,再滴加氨水,逐步中和以求缓慢地增大C2O42-浓度的方法进行沉淀。沉淀完全后再稍加陈化,以使沉淀颗粒长大,避免穿滤。
(3)必须彻底洗去沉淀表面及滤纸上的C2O42-和Cl-。
仪器与药品
仪器:分析天平、酸式滴定管、烧杯、漏斗、量筒、水浴。
药品:0.02mol·L-1KMnO4标准溶液、6mol·L-1HCl溶液、1mol·L-1H2SO4溶液、3mol·L-1NH3·H2O、0.25mol·L-1(NH4)2C2O4溶液、0.1%(NH4)2C2O4溶液、0.1%甲基橙指示剂、10%柠檬酸铵、0.1mol·L-1AgNO3溶液、2mol·L-1HNO3溶液(滴瓶装)、石灰石样品。
实验步骤
1.试样的溶解
准确称取石灰石试样0.1~0.2g置于400mL烧杯中,滴加几滴水润湿①,盖上表面皿,从烧杯嘴缓慢滴入6mol·L-1HCl溶液8~10mL,同时不断轻摇烧杯使试样溶解②。待停止发泡后,小火加热煮沸2min。冷却后用水淋洗表面皿和烧杯内壁,使飞溅部分进入溶液中。
2.沉淀的制备
在试样溶液中加入5mL10%柠檬酸铵溶液③和120mL水,加入2滴甲基橙指示剂(溶液是什么颜色?),再加入15~20mL0.25mol·L-1(NH4)2C2O4④。加热至70~80℃,在不断搅拌下缓慢滴加3mol·L-1NH3·H2O至溶液刚刚变成黄色⑤,盖上表面皿,静置过夜⑥(或者将溶液置于水浴上加热30min,同时用玻璃棒搅拌,冷却)。
3.沉淀的过滤和洗涤
在漏斗上放好滤纸,做成水柱,将陈化后的溶液以倾泻法过滤。用0.1%冷(NH4)2C2O4溶液洗涤⑦沉淀3~4次,再用水洗涤至滤液不含Cl-、C2O42-为止。在洗涤接近完成时,可用表面皿接取滤液约1mL,加入3滴AgNO3溶液,混匀后放置1min,如无浑浊现象证明已洗涤干净。注意在过滤和洗涤过程中,应尽量使沉淀留在烧杯中。
4.沉淀的溶解和滴定
将带有沉淀的滤纸小心地展开并贴在原贮沉淀的烧杯内壁上(沉淀向杯内),用50mL1mol·L-1H2SO4溶液将滤纸上的沉淀洗入烧杯内,用水稀释至100mL,加热至75~85℃后,用0.02mol·L-1KMnO4溶液滴至溶液刚好呈现粉红色。再将滤纸浸入溶液中⑧,用玻璃棒搅拌,若溶液褪色,再滴入KMnO4溶液,直至浅粉色刚出现并经30s不褪色,即为终点。计算试样中钙的含量。
注释
①先用少量水润湿,以免加HCl溶液时产生的CO2将试样粉末带走。
②如试样不能溶尽,可加热帮助溶解,如仍有少量酸不溶物不被溶解,应按以下方法制取试液:称取0.5~1g试样,加少量水润湿后盖上表面皿,缓缓滴加6mol·L-1HCl溶液35mL,停止发泡后,微沸2min,冷却后,仔细将全部物质转入250mL容量瓶中,加水稀释至刻度,摇匀,静置,使少量酸不溶物沉降。准确吸取50.00mL清液进行分析。如酸不溶物较多且对分析精度要求又较高时,则应按碱熔法制取试液后分析。
③若试样中含有Fe3+和Al3+等杂质,需加入柠檬酸铵掩蔽Fe3+和Al3+,以免生成胶体和共沉淀,其用量视Fe3+和Al3+的含量多少而定。
④甲基橙显红色说明溶液呈酸性。在酸性溶液中,加入(NH4)2C2O4溶液后,不应产生沉淀。若此时生成沉淀,说明溶液的酸性不足,这时应在搅拌下滴加6mol·L-1HCl至沉淀溶解。但勿多加HCl,否则用氨水调节pH值时,用量较大。
⑤调节pH值至3.5~4.5,使CaC2O4沉淀完全,MgC2O4不沉淀。
⑥放置过夜的目的是使沉淀陈化,以便获得颗粒粗大的晶形沉淀。但对Mg含量高的试样不宜久置,以免后沉淀。这时应将沉淀置水浴上保温30min,并随时搅拌,用这种方式可以代替放置,使沉淀陈化。
⑦先用沉淀剂稀溶液洗涤,利用同离子效应,降低沉淀的溶解度,以减小溶解损失,并且洗去大量杂质。
⑧在酸性溶液中滤纸消耗KMnO4溶液,接触时间越长,消耗越多,因此只能在滴定至终点前才能将滤纸浸入溶液中。
思考题
(1)沉淀CaC2O4时,为什么要采用先在酸性溶液中加入沉淀剂(NH4)2C2O4,而后滴加NH3·H2O中和的方法使CaC2O4沉淀析出?加入甲基橙指示剂的目的是什么?
(2)本实验制备晶形CaC2O4沉淀的主要操作条件是什么?
(3)什么叫倾泻法过滤?其优点是什么?
(4)洗涤CaC2O4沉淀时,为什么先用稀(NH4)2C2O4溶液洗,然后再用水洗?为什么要洗到滤液中不含Cl-、C2O42-?怎样判断Cl-、C2O42-洗净没有?
(5)CaC2O4沉淀生成后为什么要陈化?
(6)如果将带有CaC2O4沉淀的滤纸一起投入烧杯中,以H2SO4处理后再用KMnO4溶液滴定,这样操作对结果有什么影响?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















