物质及性质
物质及性质
1.部分物质的名称
C:碳、金刚石、石墨。
Hg:水银、汞。
CaO:生石灰、氧化钙。
CO2:干冰(固体二氧化碳)。
H2SO3:亚硫酸。
HCl:盐酸、氢氯酸。
H2S:氢硫酸。
Ca(OH)2:熟石灰、消石灰。
NaOH:苛性钠、火碱、烧碱。
Na2CO3:纯碱、碳酸钠。
Na2CO3·10H2O:十水碳酸钠、纯碱晶体。
NaHCO3:碳酸氢钠、酸式碳酸钠、小苏打。
CuSO4·5H2O:胆矾、蓝矾、硫酸铜晶体。
Cu2(OH)2CO3:铜绿、孔雀石(可分解为三种氧化物)。
C2H5OH:酒精、乙醇。
CH3COO-:醋酸根离子。
NH3:氨气,碱性气体。
NH3·H2O:氨水、一水合氨,不含金属离子,有碱的通性。
NaNO2:亚硝酸钠,有毒。
2.物质的颜色
单质:Cu紫红,Au黄,S黄,B黄或黑,F2淡黄绿,C(石墨)黑,Cl2黄绿,C(金刚石)无,Br2红棕,Si灰黑,P白、黄、红棕,I2紫黑。
氧化物:NO2棕红,ClO2黄,Na2O2浅黄,Pb3O4橘红,K2O黄,MnO绿,CuO黑,MnO2黑,Ag2O棕黑,FeO黑,ZnO白,Fe3O4黑,Hg2O黑,Fe2O3红棕,HgO红或黄,Cu2O红。
氧化水化物:Fe(OH)3红褐,HNO2亮蓝,Cu(OH)2蓝。
含银的盐:Ag2S黑,Ag2CO3黄,Ag3PO4黄,AgF黄,AgCl白,AgBr浅黄,AgI黄。
含铁的盐:FeS黑棕,FeS2黄,FeCl3·6H2O棕黄,FeSO4·9H2O蓝绿,Fe2(SO4)3·9H2O棕黄,Fe3C灰,FeCO3灰。
含铜的盐:CuS、Cu2S黑,CuFeS2黄,CuCl2棕黄,CuSO4白,CuSO4·5H2O蓝,CuCl2·7H2O蓝绿,Cu2(OH)2CO3暗绿。
其他盐:ZnS白,PbS黑,Sb2S3黑或橙红,HgS红。
盐溶液离子:Cu2+蓝,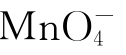 紫红,[CuCl4]2-黄,Cr2O2-7橙红,Fe2+浅绿,
紫红,[CuCl4]2-黄,Cr2O2-7橙红,Fe2+浅绿,
Fe3+棕黄。 混合物:氯水黄绿,溴水橙黄,碘水黄褐,溴的有机溶液橙红,I2的有机溶液紫红。 其他:蛋白质遇浓HNO3变黄,I2遇淀粉变蓝,Fe3+遇酚酞溶液变紫。
3.不同性质的物质
白色固体:MgO,P2O5,CaO,NaOH,Ca(OH)2,KClO3,KCl,Na2CO3,NaCl,无水CuSO4;银、铁、镁、铝、液汞为银白色。
黑色固体:石墨,炭粉,铁粉,CuO,MnO2,Fe3O4;KMnO4为紫黑色。
红色固体:Cu,Fe2O3,HgO,红磷。
溶液颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色;其余溶液一般无色。高锰酸钾溶液为紫红色。
沉淀(即不溶于水的盐和碱):①盐:一般为白色沉淀,如:CaCO3、BaCO3(溶于酸),AgCl、BaSO4(也不溶于稀HNO3);②碱:Cu(OH)2为蓝色沉淀,Fe(OH)3为红褐色沉淀,其余碱一般为白色沉淀。
气味:①有刺激性气味的气体:NH3、SO2、HCl,皆为无色;②无色无味气体:O2、H2、N2、CO2、CH4、CO(剧毒);③有刺激性气味的液体:盐酸、硝酸、醋酸,酒精为有特殊气味的液体。
有毒物质:气体CO,液体CH3OH,固体NaNO2、CuSO4(其中CuSO4可作杀菌剂,与熟石灰混合配成天蓝色的黏稠状波尔多液)。
4.金属活动性顺序
由强至弱:钾K,钙Ca,钠Na,镁Mg,铝Al,锌Zn,铁Fe,锡Sn,铅Pb(氢H),铜Cu,汞Hg,银Ag,铂Pt,金Au。
金属活动性的规律有以下几点:
(1)金属位置越靠前,活动性越强,越易失去电子变为离子,反应速率越快;
(2)排在氢前面的金属能置换酸里的氢,排在氢后的金属不能置换酸里的氢,不与酸发生反应;
(3)排在前面的金属能把排在后面的金属从其盐溶液中置换出来,排在后面的金属与排在前面的金属的盐溶液不发生反应;
(4)混合盐溶液与一种金属发生置换反应的顺序是先远后近。
注意:单质铁在置换反应中总是变为+2价的亚铁。
金属从酸中置换出氢的反应可表示为:
金属+→酸盐+H2↑
这类反应有以下特点:等质量金属与足量酸反应,放出氢气由多至少顺序为:Al>Mg>Fe>Zn;等质量的不同酸与足量金属反应,酸的相对分子质量越小放出氢气越多;等质量同种酸与足量不同金属反应,放出氢气一样多。反应后金属消失或变轻,溶液变重。
金属从盐中置换出另一种金属的反应可表示为:
金属+→盐溶液新金属+新盐
金属的相对原子质量>新金属的相对原子质量时,反应后溶液的质量变重,金属变轻;金属的相对原子质量<新金属的相对原子质量时,反应后溶液的质量变轻,金属变重。
5.10和18电子微粒
10和18电子微粒见表12-1和表12-2。
表12-1 10电子的微粒
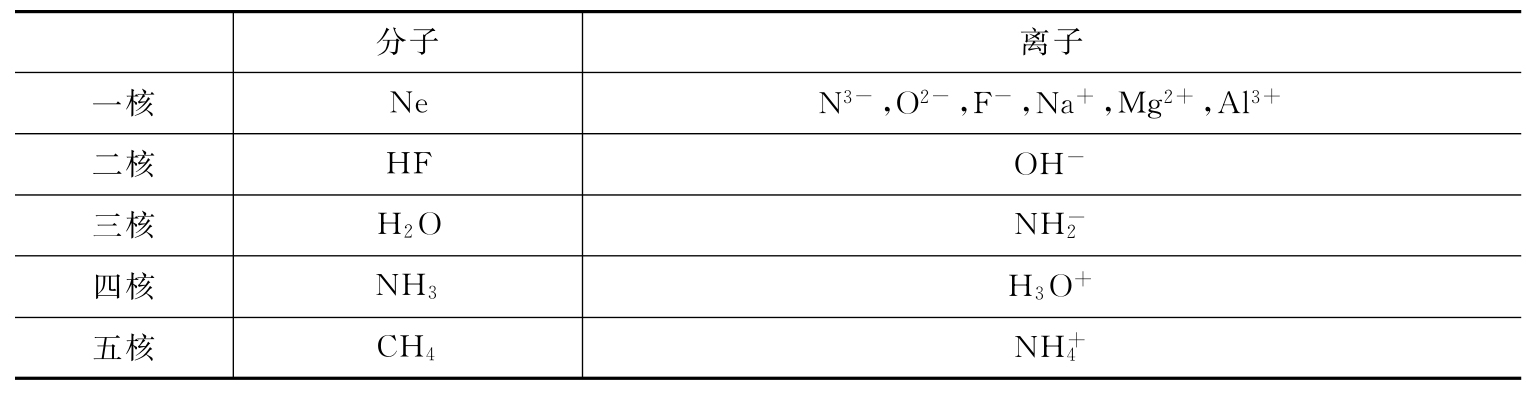
表12-2 18电子的微粒
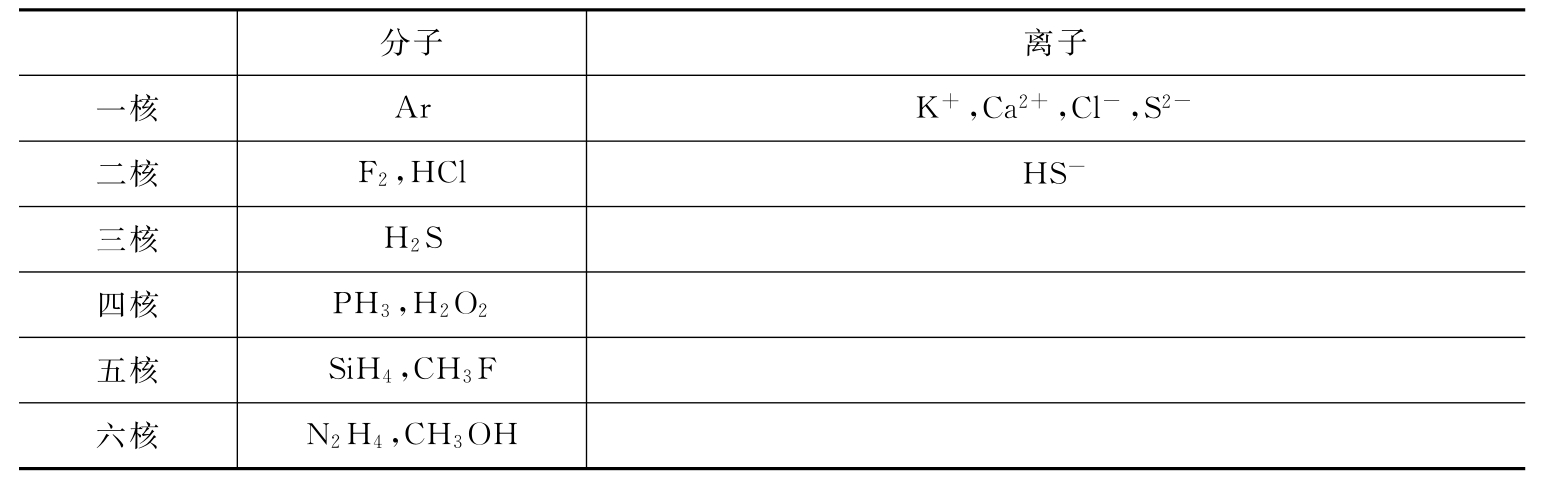
注:其他诸如C2H6、N2H+5、N2H2+6等亦为18电子的微粒。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















