5.3 金属辅基与酶活性
SOD是金属酶,在酶促反应中作为辅基起着至关重要的作用。金属离子有的直接参与催化,如Cu2+;有的维持构象,如Zn2+,确保反应的正常进行。
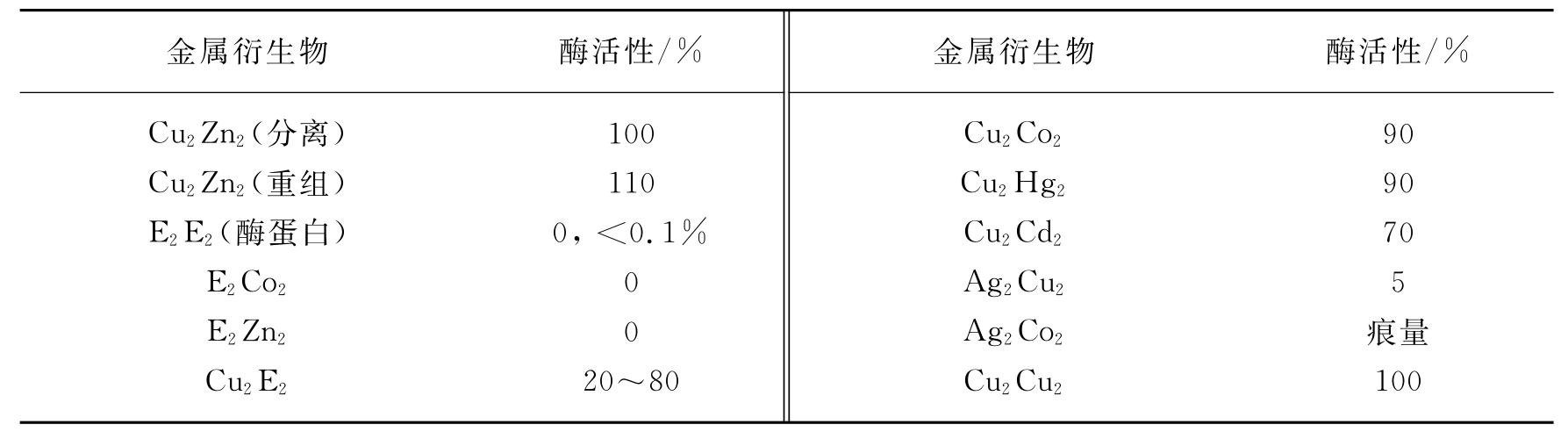
牛红细胞Cu,Zn-SOD金属辅基Cu直接与酶活性有关。在pH为3.8的醋酸钠缓冲液中,金属辅基Cu和Zn被EDTA螯合后,酶活性丧失。根据这个原理建立了制备去金属辅基的酶蛋白的方法。McCord和Fridovich首先采用对pH为3.8的醋酸钠缓冲液(含1mmol/L EDTA)透析的方法制备铜、锌的Apo-SOD。在去Cu、Zn后的酶蛋白中单独加入Cu后,酶活性就可以大部分恢复。一系列金属离子取代衍生物的研究表明,某些二价的金属离子如Co(Ⅱ)和Hg(Ⅱ),可以取代Zn(Ⅱ)的作用,但是没有任何一种金属能够取代Cu(Ⅱ)而起恢复酶活性的作用。一系列金属离子取代对酶活性的影响见表5-10。Cu对于酶活性的作用从DDC(二乙基二硫代氨基甲酸盐)螯合实验中得到证实。DDC可以选择性地从Cu,Zn-SOD中除去Cu而不除去Zn,单独去Cu后的E2Zn2-SOD没有酶活性。这不仅从离体实验中得到证实,而且也可从整体动物实验中得出结论。当动物注射DDC后,体内Cu,Zn-SOD的合成受到抑制,在全血、脑、肝中SOD活性下降。Fe为Fe-SOD催化活性所必需,而Mn也与Mn-SOD的活性直接相关。从大肠杆菌提取的Mn-SOD在含有20mmol/L的8-羟基喹啉、2.5mol/L EDTA的Tris-HCl缓冲液内透析时,随着Mn的丧失,酶活性也一起丧失,而在同样的体系中再对0.01mol/L的MnCl2透析,又可以使酶活性恢复。用Co(Ⅱ)、Ni(Ⅱ)、Mg(Ⅱ)、Fe(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)等其余9种不同价态的金属离子取代Mn(Ⅱ),发现都不能使酶复活。而且在与酶蛋白结合方面,只有在100倍过量的条件下Ni(Ⅱ)、Cu(Ⅱ)和Zn(Ⅱ)这三种离子才能有效地与Mn(Ⅱ)竞争,可见酶蛋白对Mn(Ⅱ)具有极高的亲和力。一个很有意思的事实是,尽管Mn-SOD和Fe-SOD在氨基酸序列及结构上具有显著的同一性,但是对于除去Mn的酶蛋白,Fe却不能有效地与Mn竞争,而且即使在Fe浓度大大过量的条件下结合到酶蛋白上面,酶也不能复活。这说明尽管氨基酸序列有同一性,但在发挥催化活性时真正起决定性作用的还是金属辅基,这表现了金属辅基在催化活性方面的高度专一性。在这方面还有一些报道,认为单单金属离子就能起SOD的作用,无机Cu离子便可催化 发生歧化反应,而一般的Cu(Ⅱ)-小肽的配合物也同样具有SOD的活性,尽管其催化效率可能不如SOD高。还有文献报道,在一种缺乏SOD的细菌中以Mn(Ⅱ)离子来取代SOD,能发挥清除
发生歧化反应,而一般的Cu(Ⅱ)-小肽的配合物也同样具有SOD的活性,尽管其催化效率可能不如SOD高。还有文献报道,在一种缺乏SOD的细菌中以Mn(Ⅱ)离子来取代SOD,能发挥清除 的作用。
的作用。
表5-10 Cu,Zn-SOD的不同金属衍生物的酶活性
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














