化学家看原子
化学家看原子
哲学家主要通过思考提出了原子学说,化学家又是如何看待这一学说的呢?英国化学家玻义耳受伽桑狄著作的影响很大,他曾说:“古代哲学家的那些理论,现在又在大声喝彩中复兴了,仿佛是现代哲学家发现的。”玻义耳相信宇宙万物可以分解成大小不同且形状千变万化的微小粒子。在《怀疑派化学家》(1661)一书中,他提出:“猜测世界可能由哪些基质组成是毫无用处的。人们必须通过实验来确定它们究竟是什么。”
玻义耳把任何不能通过化学方法将其分解成更简单组分的物质称为元素,在他看来,“元素……是指某种原始的、简单的、一点也没有掺杂的物体。元素不能用任何其他物体造成,也不能彼此相互造成。元素是直接合成所谓完全混合物的成分,也是完全混合物最终分解成的要素”。后来的化学家拉瓦锡也把“元素或要素”定义为“分析所能达到的终点”。

图3-3 伽桑狄和道尔顿
原子学说是在化学家进一步的阐述中逐渐形成理论的。19世纪初,化学家道尔顿(见图3-3)进一步诠释了化学原子学说的基本观点:化学元素由非常微小的、不可再分的物质粒子——原子组成,原子在参与所有化学变化时保持自身的独特性质;同一元素的所有原子的性质特别是重量完全相同,而不同元素的原子各有独特的性质;在数量上以简单比例混合元素的原子时可以发生化合。道尔顿关于化学原子的经典概括最早记录在1803年9月6日的笔记中,5年以后的1808年才正式发表于《化学哲学的新体系》,由此近代原子理论得以建立。
18、19世纪许多化学家对化合物组成进行了定量研究,逐渐得出一些定律,如定比、倍比和当量比例定律。原子理论作为一种知识框架,已经可以成功地解释这些定律,这为原子学说获得更多的支持和应用奠定了基础。
现在,初学化学的学生就知道水分子是由两个氢原子和一个氧原子组成的,其分子式可以表示为H2O(其结构如图3-4所示),但是,在19世纪很长的一段时间中,水分子却表示为HO。道尔顿的学说当时遇到的困惑是不能从化合比例决定原子的相对重量。人们知道水是由氢与氧按1∶8的质量比合成的,但氢与氧的相对重量却无从得知,因为无法确定水中氢、氧元素各有多少个原子。
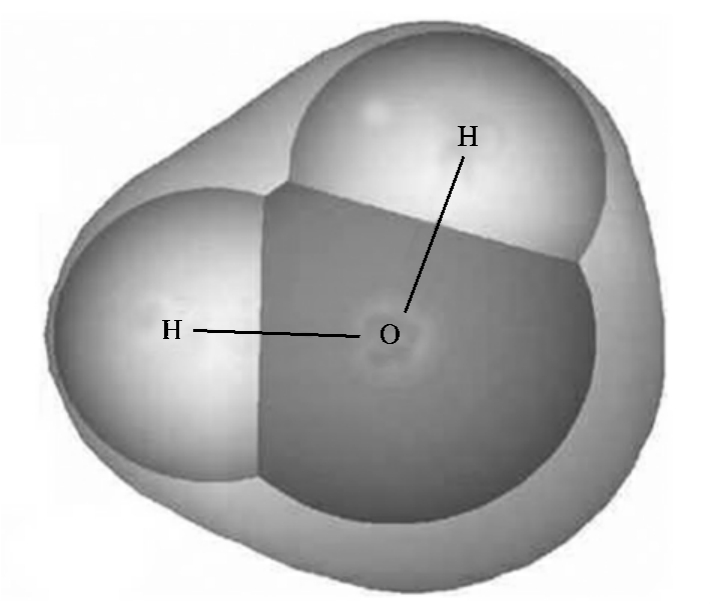
图3-4 水分子
实际上早在1811年,意大利物理学家、化学家阿弗加德罗就已经提出了关于气体性质的阿弗加德罗假说,即同温、同压、同体积的气体含有相同数目的分子。这一假说正是理解某种化合物中每种元素各有多少个原子以及得出正确的原子量所需要的方法。很遗憾,阿弗加德罗假说长期未受重视。直到1860年在卡尔斯鲁厄举行的化学家会议上,有化学家强调这一假说对化学的重要性,阿弗加德罗假说才拨云见日,很快得到化学家们的认可,被假设不可再进一步分割的“元素”成为化学家眼中构成宇宙万物的基本成分。
随着发现的元素种类的增加,化学家认识到的不同类的原子也逐渐增多。这样一来,2 000多年以来人们苦苦寻找的简单的统一性还有没有可能呢?在原子以下尺度上,是否还存在构成这些不同原子的更为基本的“碎片”呢?
1815前后,在伦敦行医的年轻医学博士、后来成为化学家的普劳特(1785~1850)发表了两篇文章,提出所有其他元素的相对原子质量都是氢的相对原子质量的整数倍;氢是原始物质或“第一物质”,而所有其他元素都只是氢原子的组合体。
因为普劳特假说挺简单,很诱人,所以,除了那些正在或准备对相对原子质量进行精确测定的人以外,一度为大多数化学家所接受。但是,比利时分析化学家斯塔(1813~1891)在1860年以后所做的相对原子质量的精确测定表明,相对原子质量实际上并非整数,如氯原子的相对重量是35.46,这与普劳特的假说是相冲突的。由此斯塔得出结论:普劳特假说“只不过是一个假象,是一个肯定与实验矛盾的纯粹假想”。事实无情,作为科学插曲的普劳特猜想被否定了。
1869年,俄国著名化学家门捷列夫(见图3-5)发表元素周期表。周期表的结构性和规律性提示,原子自身必然存在不断作周期性重复的结构。这背后隐藏着什么秘密呢?在20世纪原子核的结构被发现之前,没有人知道为什么在周期表里会出现这样的规律性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















