(一)沉淀的生成
【根据溶度积规则,生成沉淀的必要条件是 J>K■sp】。通常采用加入沉淀剂的方法。加入沉淀剂,增大离子浓度,使平衡向生成沉淀的方向移动。
【例7-3】将2.0×10—4mol·L—1的BaCl2溶液和等体积1.0×10—3mol·L—1的K2CrO4溶液混合后,有无BaCrO4沉淀产生?[已知K■sp(BaCrO4)=1.2×10—10]
解:两溶液等体积混合后,溶液中:
根据溶度积规则,溶液中有BaCrO4沉淀生成。
【例7-4】在0.050L3.0×10—4mol·L—1Pb2+溶液中加入0.10L0.0030mol·L—1的I—溶液后,能否产生PbI2沉淀?[已知K■sp(PbI2)=7.1×10—9]
解:混合溶液的总体积为0.15L,溶液中各离子浓度为:
根据溶度积规则,无PbI2沉淀产生。
【例7-5】在0.50mol·L—1MgCl2溶液中加入等体积的0.10mol·L—1的氨水,若此氨水中同时含有0.020mol·L—1的NH4Cl,试问Mg(OH)2能否沉淀?已知K■sp[Mg(OH)2]=1.8×10—11;K■b(NH3·H2O)=1.74×10—5。
解:混合液中:
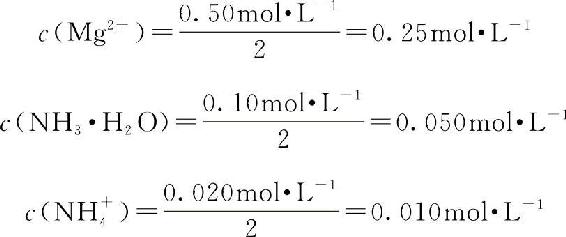
溶液中的OH—是由0.050mol·L—1NH3·H2O和0.010mol·L—1NH4Cl组成的缓冲溶液提供的,根据缓冲溶液求OH—浓度的计算公式得:
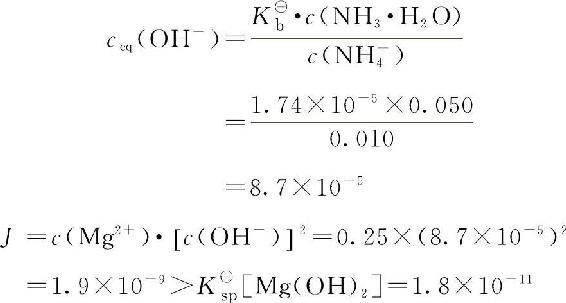
根据溶度积规则,有Mg(OH)2沉淀产生。
以上讨论的沉淀的生成都是只生成一种沉淀的情况,实际上溶液里常常同时会有多种离子,而且它们都能与同一沉淀剂反应生成多种沉淀。在这种情况下,沉淀的生成将按什么顺序进行呢?第二种离子沉淀时,第一种离子沉淀到什么程度呢?现以AgNO3沉淀Cl—、I—为例,运用溶度积规则讨论如下:
【例7-6】在含有0.010mol·L-1Cl—和0.010mol·L—1I—的溶液中,逐滴加入AgNO3,哪一种离子先沉淀?当第二种离子开始沉淀时,第一种离子是否沉淀完全?(忽略滴加AgNO3溶液后,引起的体积变化)
解:根据溶度积规则,AgCl和AgI刚开始沉淀时所需要的Ag+相对浓度分别是:
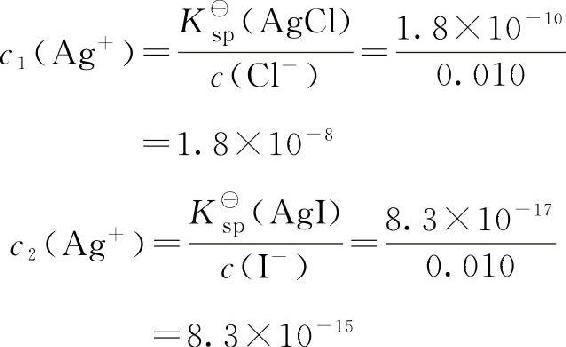
结果表明,AgI开始沉淀时所需的c2(Ag+)比AgCl开始沉淀时所需要的c1(Ag+)小得多,显然,逐滴加入AgNO3时,离子浓度的幂次方乘积首先达到AgI的溶度积,AgI先沉淀出来。继续滴加AgNO3,当溶液中J≥K■sp(AgCl)时,AgCl开始沉淀。
当Cl—开始沉淀时,溶液对于AgCl来说已达饱和,这时Ag+同时满足两个沉淀平衡,即:
设Cl—浓度不随AgNO3的加入而变化,c(Cl—)≈ceq(Cl—),则
计算结果说明,AgCl开始沉淀时,I—早已沉淀完全了。在一般分析中,当离子浓度小于或等于1.0×10—5mol·L—1时,可认为该离子已经沉淀完全了。
【这种加入一种沉淀剂,使溶液中原有多种离子按照到达溶度积的先后顺序分别沉淀出来的现象称为分步沉淀(fractional precipitation)】。离子沉淀的顺序决定于沉淀物的K■sp和被沉淀离子的浓度。对于同类型的沉淀,若沉淀的K■sp相差较大,则K■sp小的先沉淀,K■sp大的后沉淀;若两者K■sp相差不大,且被沉淀离子的浓度又相差过于悬殊的话,就要具体问题具体分析了。对于不同类型的沉淀,因有不同幂次的关系,就不能直接根据K■sp值来判断沉淀的先后顺序,必须根据计算结果确定。例如,用逐滴加入AgNO3沉淀0.010mol·L—1的Cl—和0.010mol·L—1的CrO24—,AgCl和Ag2CrO4开始沉淀时所需的Ag+相对浓度分别是:
虽然K■sp(AgCl)>K■sp(Ag2CrO4),但沉淀Cl—所需的Ag+浓度较小,反而是AgCl先沉淀。
掌握了分步沉淀的原理,根据具体情况,适当地控制条件,可以达到分离离子的目的,例如难溶氢氧化物的分离、难溶硫化物的分离等,将在下一节详细讨论。
(三)沉淀的转化
【在含有沉淀的溶液中,加入适当试剂,使这种沉淀转化为另一种沉淀的过程称沉淀的转化(transformation of precipitation)】。沉淀的转化一般有下列两种情况。
1.难溶强电解质转化为更难溶的强电解质
将(NH4)2S溶液加入到盛有黄色PbCrO4沉淀的试管中,并搅拌之,可以观察到沉淀由黄色变为黑色,转化过程可表示如下:
由于K■sp(PbS)<K■sp(PbCrO4),Pb2+和S2—生成了更难溶的PbS沉淀,从而使ceq(Pb2+)降低,这时对于PbCrO4来说,J<K■sp,平衡右移,PbCrO4沉淀逐渐溶解;而对于PbS来说,J>K■sp,PbS沉淀不断生成。当转化达平衡时,转化的总反应式为:
PbCrO4(s)+S2—■■■PbS(s)+CrO24—转化反应平衡常数:
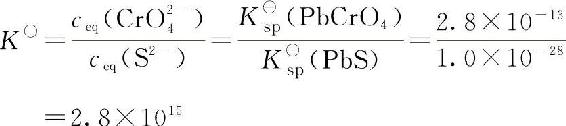
平衡常数K■很大,因此转化反应不仅能自发进行,而且进行得很完全。根据转化平衡常数的大小可以判断转化的可能性。K■>1,转化可以进行;K■越大,转化进行的程度越大;K■≥106,转化反应进行得比较完全。
2.难溶强电解质转化为稍易溶的难溶强电解质
一般来说,由难溶强电解质转化为更难溶的强电解质,由于转化反应的K■>1,转化较容易实现。反过来,由溶解度小的沉淀转化为溶解度较大的沉淀,由于转化反应的K■<1,这种转化比较困难。但当两种沉淀溶解度相差不是太大时,控制一定的条件,还是可以进行的。
例如:BaSO4的溶解度比BaCO3的溶解度小[K■sp(BaSO4)=1.1×10—10<K■sp(BaCO3)=5.1×10—9],但控制条件,将BaSO4用Na2CO3处理,还是可以转化为BaCO3沉淀的。转化反应如下:
BaSO4(s)+CO23—■■■BaCO3(s)+SO24—
平衡常数
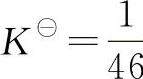
,不是太小,只要控制溶液中的c(CO23—)>46c(SO24—),反应即可正向进行。实际操作中,可用饱和Na2CO3溶液处理BaSO4沉淀3~4次,转化反应进行得还比较完全。
必须指出的是,这种转化只适用于溶解度相差不大的沉淀之间。如果两沉淀的溶解度相差很大,转化反应的K■很小,这种转化将是十分困难的,甚至是不可能的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















