3.2.3 多相离子平衡
1.多相离子平衡
在一定温度下难溶电解质晶体与溶解在溶液中的离子之间存在溶解和结晶的平衡,称作多相离子平衡,也称沉淀溶解平衡。多相离子平衡也是水溶液中十分重要的平衡。它也遵循化学平衡的一般规律,每个多相离子平衡都具有一个特征的平衡常数,称为化合物的溶度积常数,用 表示。
表示。
以难溶电解质AgCl在水中的多相离子平衡为例:
![]()
(当AgCl(s)晶体仍然存在时,[AgCl]可以认为是不变的,在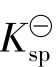 表达式中可并入常数项中。)
表达式中可并入常数项中。)
若难溶盐的组分离子比不是1∶1时,其多相离子平衡式中,相应离子的系数不是1,则其 的表达式及相关计算中,有关离子的浓度项,应以其平衡系数作指数的幂代替。
的表达式及相关计算中,有关离子的浓度项,应以其平衡系数作指数的幂代替。

2.溶解度和溶度积
通常人们还用溶解度来衡量或表征难溶盐在水中的溶解特性。广义地说,某物质的溶解度就是指一定温度下,一定量的溶液或溶剂中,能溶解该物质的最大量,通常可用该物质的饱和溶液的体积摩尔浓度S表示。
溶解度S和溶度积常数 都能反映难溶电解质的溶解性的大小,并可相互换算。如对AB(1∶1)型难溶电解质,其饱和溶液(浓度为S)中存在下列平衡:
都能反映难溶电解质的溶解性的大小,并可相互换算。如对AB(1∶1)型难溶电解质,其饱和溶液(浓度为S)中存在下列平衡:

对AB2(1∶2)型难溶电解质,其饱和溶液中存在下列平衡:
![]()

其他类型难溶电解质的 与S之间换算也可相似处理。
与S之间换算也可相似处理。
在用溶度积常数比较难溶电解质的溶解度大小时要注意:
①同类型难溶电解质可以直接用溶度积常数比较溶解度;
②不同类型难溶电解质要用溶度积常数计算出溶解度后再进行比较,不能简单认为溶度积常数小的溶解度一定小。
【例3.2-7】在25℃时,AgCl的溶度积常数为1.77×10-10,Ag2CrO4的溶度积常数为1.90×10-12,试比较两者的溶解度(以mol·L-1为单位)大小。
解:虽然AgCl的溶度积常数比Ag2CrO4的溶度积常数大,因为两者是不同类型的难溶电解质,因此不能简单地用溶度积常数大小来比较其溶解度,而要通过计算作比较:

答:Ag2CrO4的溶解度为0.78×10-4mol·L-1,AgCl的溶解度为1.33×10-5mol·L-1。Ag2CrO4的溶解度大于AgCl的溶解度。
3.溶度积规则
在溶液中,有关离子能否生成难溶晶体析出,可用相应离子的实际浓度积与其溶度积常数相比较来作出判断,这就叫溶度积规则。这实际上是平衡和平衡移动规则在多相离子平衡中的应用。
例如,在含AgNO3和K2CrO4混合溶液中,可用溶度积规则来判断是否有Ag2CrO4沉淀生成:
![]()
令[Ag+]2· 分别表示指定溶液中Ag+和
分别表示指定溶液中Ag+和 实际的相对浓度。而Ag2CrO4的溶度积常数
实际的相对浓度。而Ag2CrO4的溶度积常数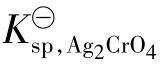 是可以查表得知的,是不随溶液中的Ag+和
是可以查表得知的,是不随溶液中的Ag+和 离子的实际浓度而变化的。
离子的实际浓度而变化的。
当Qc 时,溶液对Ag2CrO4晶体而言是未饱和的,无Ag2CrO4沉淀生成;
时,溶液对Ag2CrO4晶体而言是未饱和的,无Ag2CrO4沉淀生成;
当Qc 时,溶液为Ag2CrO4饱和溶液,达多相离子平衡;
时,溶液为Ag2CrO4饱和溶液,达多相离子平衡;
当Qc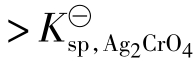 时,溶液对Ag2CrO4是过饱和的,应有Ag2CrO4沉淀生成。
时,溶液对Ag2CrO4是过饱和的,应有Ag2CrO4沉淀生成。
这里要注意的是,溶液中Ag+浓度、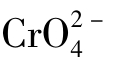 的浓度是彼此独立指定的,没有必然联系,也没有定量关系,不能简单认定[Ag+]=2
的浓度是彼此独立指定的,没有必然联系,也没有定量关系,不能简单认定[Ag+]=2 。这是与前面例题不同的。
。这是与前面例题不同的。
4.分步沉淀、沉淀转化与沉淀溶解
①若溶液中存在两种以上离子,选用某种沉淀剂可使这些离子先后沉淀析出,这就称分步沉淀。分步沉淀本质上是多种离子对同一种沉淀剂离子的争夺竞争。运用溶度积规则可以计算出在指定条件下,哪种离子会最先沉淀,哪些会随后沉淀;还能计算出某种离子应在什么浓度开始沉淀,什么条件下沉淀完全;以及当某种离子开始沉淀析出时,先前沉淀的一种离子在溶液中残存浓度等等。若第二种离子刚开始沉淀时,第一种离子浓度已经降至10-5mol·L-1以下,则可认为第一种离子已沉淀完全了。并可选用这种沉淀剂,利用分步沉淀法将两种离子完全分离。
【例3.2-8】某溶液中含有Cl-离子和 离子,浓度都为0.1mol·L-1,试用计算说明,若用Ag+作沉淀剂,哪种离子先沉淀,并说明能否用分步沉淀将Cl-和
离子,浓度都为0.1mol·L-1,试用计算说明,若用Ag+作沉淀剂,哪种离子先沉淀,并说明能否用分步沉淀将Cl-和 完全分离?
完全分离?
解:要使Cl-呈AgCl沉淀所需Ag+浓度为
![]()
要使CrO2-4成Ag2CrO4沉淀所需Ag+浓度为
![]()
显然[Ag+]AgCl<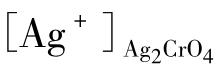 ,所以当用Ag+作沉淀剂时,上述溶液中Cl-将优先成AgCl沉淀析出。
,所以当用Ag+作沉淀剂时,上述溶液中Cl-将优先成AgCl沉淀析出。
而当Ag2CrO4开始要沉淀时,Cl-离子浓度为
![]()
所以在题示条件下,用Ag+作沉淀剂,Cl-先沉淀析出,而当 开始沉淀时,Cl-的残留浓度为4.06×10-5mol·L-1可认为Cl-离子实际上已经沉淀完全了,表明用Ag+可使题示溶液中Cl-和
开始沉淀时,Cl-的残留浓度为4.06×10-5mol·L-1可认为Cl-离子实际上已经沉淀完全了,表明用Ag+可使题示溶液中Cl-和 分步沉淀分离。
分步沉淀分离。
②利用溶度积和溶度积规则还可以判断沉淀能否转化为其他沉淀或溶解。
例如,利用溶度积可以计算沉淀转化反应的常数

表明这个沉淀转化反应比较彻底。即向Ag2CrO4溶液中加入Cl-,可使Ag2CrO4沉淀转化为AgCl沉淀。
沉淀溶解是指含有沉淀的溶液中,当有关离子浓度积小于溶度积时,沉淀会溶解。例如
![]()
由于用H+离子使 生成H2CO3,并分解成为H2O和CO2。而
生成H2CO3,并分解成为H2O和CO2。而 浓度降低可使CaCO3沉淀溶解。因而加酸可使CaCO3溶解。
浓度降低可使CaCO3沉淀溶解。因而加酸可使CaCO3溶解。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















