白腐真菌对玉米芯生物降解及酶活性变化的研究
丁 涓 赵 华
(天津市工业微生物重点实验室天津科技大学生物工程学院 天津 300222)
摘要:试验对白腐菌TST-01,PD-02,PCH-03 (黄孢原毛平革菌)三只菌株在固态培养条件下玉米芯的生物降解进行了研究。其中TST-01在玉米芯降解过程中酶活力最高降解效果最好,赖锰过氧化物酶(Manganese peroxidase) 、木质素过氧化物酶(Lignin peroxidase) 、漆酶(Laccase) 、纤维素酶和木聚糖酶的酶活在培养的第5d,第6d,第7d,第12d,第8d达到最大值,分别为1.326U/g,10.25U/g,0.0627U/g,392.54U/g和0.421U/g。培养25d后,玉米芯中纤维素、半纤维素和木质素的降解率依次为32.15%,43.68%,49.58%,蛋白质含量增加24.58%。
关键词:白腐真菌;玉米芯;生物降解;木质降解酶;纤维素酶
近几十年来,由于工业的迅速发展,资源短缺问题成为困扰人类社会发展的主要问题之一。如何进行资源的可持续利用,已成为可持续发展理论与实践研究关注的热点问题。从1997~2004年,全球玉米产量5.85~6.85亿吨,其中美国产量占世界玉米产量42%左右,居第一位[1]。中国产量名列第二位,占19%左右,同时附产玉米芯0.5亿吨[2]。玉米可以作为粮食和生产原料,玉米秸秆一般作为饲料或被燃烧,玉米芯含热量15.70MJ/kg,相当于煤热量的60%[3]。作为玉米生产的副产物,玉米芯在我国农村一直被廉价的作为燃料而烧掉,使这一资源丰富且具有很高利用价值的工业原料没有得到合理充分的利用[4]。由于玉米芯中木聚糖的含量很高,而其分子结晶度很低,所以易通过微生物酶解方式对其进行降解,从而使玉米芯获得有效的应用[5,6]。
目前西欧和日本等国都是糠醛消费大于生产的国家,而我国生产糠醛以出口为主[7,8]。玉米芯中含有大量的戊聚糖,是生产糠醛较为理想的原料[9]。玉米芯含生产糠醛的有效成分多缩戊糖最高达38%~47%,是其他原料所不及的[10]。其次,玉米芯中半纤维素的含量也是目前已发现的可再生植物中较高的,利用酸解或酶解的方法将半纤维素转化为还原性糖会产生大量的五碳糖(D-木糖和L-阿拉伯糖) ,而其中D-木糖约占90 %[11]。在本实验中,以玉米芯为原料,利用微生物生长特性对其进行改性;为玉米芯进一步的深加工作预处理,对其酶系的变化进行研究和讨论。
1 材料与方法
1.1 材料
白腐菌TST-01、PD-02、PCH-03 (黄孢原毛平革菌) (天津科技大学分离保藏)
1.2 培养基
1.2.1 种子培养
葡萄糖2%,玉米浆4%,(NH4)2SO40.04%,KH2PO40.09%,MgSO4.7H2O 0.04% VB10. 05%,pH5.0。
1.2.2 基础培养基(g/L)
NaAc 1.6g,CoCl2· 6H2O 6.8×l0-3g,NH4NO30.1g,土温-80 1.0g,KAl (SO4)2· 12H20 8.5×l0-3g,MgSO40.5g,FeSO4· 7H2O 2.7×l0-3g,ZnSO4· 7H2O6.4× l0-3g,CuSO4· 5H2O,3.0× l0-3 g,VB11.0 ×l0-3g,Na2MoO4· H2O4.3×l0-3g。
1.2.3 斜面培养基
马铃薯汁20%,葡萄糖2%,琼脂2%,pH自然。
1.2.4 发酵培养基
玉米芯(80目)加2倍于原料重的水,水中还含0.5 % (m/ v,下同) (NH4)2SO4,加上最佳无机盐配方在0.10~0.15MPa下灭菌30min。在250ml三角瓶中加入25ml液体培养基。
1.3 实验方法
1.3.1 种子培养
在250ml三角瓶中加入100ml液体培养基,于121℃,0.1Mpa下灭菌15分钟,冷却。用10ml无菌水洗下保藏于PDA斜面上的白腐菌并倒入上述的液体培养基中,用四层纱布包住瓶口。放于水浴摇床,30℃180r/min震荡培养。
1.3.2 发酵培养
将上述培养基放于121℃,0.1Mpa的高温消毒器中灭菌15~20分钟。冷却后每瓶接入已培养好的菌悬液8~10ml,摇匀,放于恒温恒湿箱中。调节干球温度为30℃,湿度86%(即湿球温度为18℃) 。
1.3.3 玉米芯成分测定
培养基质的粗蛋白按凯氏定氮法测定[12];纤维素,半纤维素和木质素含量方法进行测定[13]。
1.3.4 酶活测定
木质素过氧化物酶酶活力的测定:测反应最初3分钟内λ=651nm处吸光度变化,1个酶活力单位用每分钟每毫升培养基滤液增加0.1OD来表示。
漆酶活力以吸光率的增值表示:以△A=0.1规定为一个相对酶活单位。
锰过氧化物酶活性[14]:测反应最初3分钟内λ=240nm处吸光度变化,1个酶活力单位用每分钟每毫升培养基滤液增加0.1OD来表示。
纤维素酶活性: CMC酶活(U/g或ml)=A×n×2×2÷W其中: A:反应产生的葡萄糖毫克数n:稀释倍数2×2:半小时换算成1小时,0.5ml换算成1ml。W:酶粉重量。
木聚糖酶活力的测定:在pH=4.8,温度50℃条件下,每分钟分解木聚糖产生1微摩尔木糖定义为1个木聚糖酶活力单位(IU) 。木聚糖酶活(IU) =A×n×2÷150.3÷15×1000÷W其中: A:反应产生的木糖毫克数; n:稀释倍数; 150.3:为木糖摩尔分子量; 15: 15分钟; W:酶粉重量; 1000:是将毫克换算成微克。
2 结果与讨论
2.1 玉米芯生物降解过程中组成成分的变化
白腐菌TST-01,PD-02,PCH-03分别对玉米芯进行生物降解,分别经过25d的培养,每5d检测玉米芯中组分的变化,其结果见图1、图2、图3、图4。

图1 纤维素含量的变化
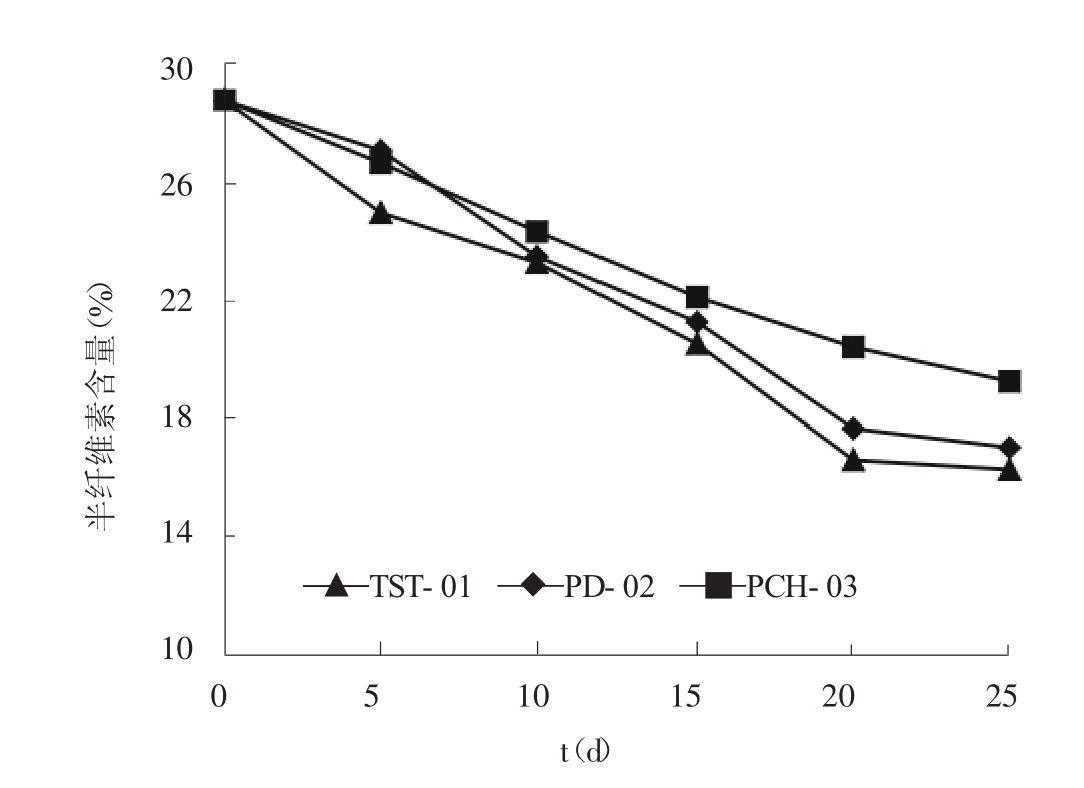
图2 半纤维素含量的变化

图3 木质素含量的变化

图4 蛋白质含量的变化
由图1可知,经菌种TST-01,PD-02,PCH-03降解玉米芯10d时,纤维素含量大幅下降,其中菌种TST-01降解玉米芯最快。25d后纤维素去除率分别为32.15%、29.48%、19.86%。由图2可知,玉米芯在菌种降解过程中,半纤维素含量不断减少。经过25d的TST-01,PD-02,PCH-03生物降解,半纤维素的去除率分别为43.68%、40.87%、33.43%,其中经TST-01降解的玉米芯中的半纤维素的去除率最大,降解效果最好。由图3可知,玉米芯经菌种降解5d时,木质素含量几乎没有变化,5d后木质素含量开始下降。25d后菌种TST-01的木质素去除率为49.58%,PD-02的木质素去除率为47.86%,PCH-03的木质素去除率为45.23%。
可以看出菌种TST-01对白腐菌的降解明显高于其他两株菌种。这表明TST-01菌株具有优良的木素降解特性。这些降解的木素有的变成小分子的木素碎片,有的可能进一步通过芳环的断裂生成脂肪酸,随后进一步完全代谢为二氧化碳和水。由图4可知,培养前基质中粗蛋白含量为7.2%,经过TST-01,PD-02和PCH-03 25d的培养,蛋白质含量分别提高了24.58%、22.36%和19.44%。
2.2 玉米芯生物降解过程中酶活性的变化
2.2.1 木质素降解酶活性的变化
微生物对木素的降解,依靠的是其分泌的酶系,不同的菌种可能有不同的降解酶系统。一个菌种的木素降解能力是由它的生理特性和总体代谢能力共同决定的[15]。本试验测定了白腐菌TST-01,PD-02,PCH-03在玉米芯降解过程中Laccase,Manganese peroxidase,lignin peroxidase酶活性,结果见图5、图6、图7。

图5 Laccase酶活力的变化

图6 Manganese peroxidase酶活力的变化

图7 Lignin peroxidase酶活力的变化
由图5,图6,图7可知,玉米芯经白腐菌TST-01,PD-02和PCH-03培养,Laccase酶活分别在第7d第,8d第,9d达到最高值,为0.0627U/g、0.0563U/g、0.0514U/g,Manganese peroxidase酶活分别在第5d,第6d和第7d达到产酶高峰,酶活值为1.326U/g、1.082U/g、1.032U/g,Lignin peroxidase酶活分别在第6d,7d第和第7d达到最高值,为10.25U/g 、9.76U/g、9.21U/g。由此可见,白腐菌TST-01的酶系表现出较高的酶活活性。比较三种不同的酶可见,Manganese peroxidase和Lignin peroxidase表现出较高的酶活活性,是参与植物生物降解重要的胞外酶。
2.2.2 纤维素酶和木聚糖酶活力的变化
由于木素生物降解往往出现在次生代谢过程中,所以白腐菌对木素的选择性降解是比较困难的[16],在木质素降解的同时,纤维素和半纤维素也被降解。由此本试验考察了白腐菌TST-01,PD-02和PCH-03在固态培养前25d分泌的纤维素酶和木聚糖酶活性,见图8,9。

图8 纤维素酶活力的变化

图9 木聚糖酶活力的变化
由图8,9可以看出,随着白腐菌TST-01,PD-02和PCH-03的生长,木聚糖酶分别在第8d,第8d和第10d表现出较高的酶活,其活性峰值为0.421U/g、0.345U/g、0.33U/g,而纤维素酶分别在第12d,第14d和第16d表现出较高的酶活,其活性峰值为392.54U/g、423.9U/g、383.8U/g,酶活升高较快,之后逐渐降低。
3 结论
在利用白腐菌TST-01,PD-02和PCH-03降解玉米芯的过程中,白腐菌TST-01在酶系和玉米芯降解率上都优于其他两支菌株。在白腐菌TST-01降解玉米芯的过程中,纤维素,半纤维素和木质素的降幅分别为32.15%,43.68%,49.58%。玉米芯中粗蛋白的含量上升了24.58%。
在酶系变化过程中,Laccase酶活在第7d达到最高值,为0.0627U/g。MnP酶活在第5d达到产酶高峰,酶活值为1.326U/g。 Lip酶活在第6d达到最高值,为10.25U/g。木聚糖酶第8d表现出较高的酶活,其活性峰值为0.421U/g,而纤维素酶在第12d,表现出较高的酶活,其活性峰值为392.54U/g,酶活升高较快,之后逐渐降低。
参考文献:
[1]Allina S.M.,Pri-Hadash A.,Theilmann D.A.,EllisB.E.,Douglas C. [J]J.,4-Coumarate: coenzyme A ligase in hybrid poplar,Plant Physiol. 116(1998):743~754
[2] Atanassova R.,Favet N.,Martz F.,Chabbert B.,TollierM.T.,Monties B.,Fritig B.,Legrand M.,Altered lignincompositionintransgenictobacco expressing O-methyltransferasesequencesinsenseand antisenseorientation,Plant[J]J. 8(1995):465~477
[3]庄贵.利用纤维素原料发酵生产乳酸的研究[J ].郑州粮食学院报,2000,21(1) :10~12
[4]王体科.世界植物纤维水解概况[J].世界林业研究,2003,(6) :51~57
[5] Tao H ,Gonzalez R ,Imgram L O et al. Engineering a homoethanol pathway in Escherichia coli :increased glycolytic flux and levels of expression of glycolytic genes during xylose fermentation [J].J Bacteriol ,2001 ,183 : 2979~2988
[6]徐海娟,梁文芷.白腐菌降解木素酶系及其作用机理[J].环境污染治理技术与设备,2001,1 (3) : 51~54
[7]Mistsuyasu Okabe . Noriyasu Ohta. YongSooPark[J ]. Journal OfFermentation and Bioengineering ,2001 ,76(2):117~121
[8] Sun,R.C.; Tomkinson,J. Comparative study of lignins isolated by alkali and ultrasound-assisted alkali extractions from wheat straw. [J]Ultrason.Sonochem. 2002,9,85-93.Separation and Characterization of Cellulose 409
[9]Evans,R.; Wallis,A.F.A. Cellulose molecular weights determined by viscosity. [J] J. Appl. Polym. Sci. 1999,37: 2331~2340
[10]Sun,X.F.; Sun,R.C. Comparative studyofacetylation ofrice strawfiber with or without catalysts. [J]Wood & Fiber Sci. 2002,34: 306~317
[11] Jaskelainen,A.S.; Tapanila,T.; Poppius-Levlin,K. Carbohydrate reactions in peroxyacetic acid bleaching.[J]J. Wood Chem. Technol. 2000,20: 43~59
[12] Kuwahara M. Separation and characterization of two extracellular H2O2-dependent oxidases from ligninolyticcultures ofPhanerochaete chrysosporium[J]. FEMS,1984,169: 247~250
[13]王玉万、徐文玉,等.木质纤维素固体基质发酵物中半纤维素、纤维素和木素的定量分析程序. [J]微生物学通报,14:81~84 1997
[14] Glenn J K,Gold MH.Effect of various media and supplements on production by some white rot fungi. Bioresour[J]Technol,2001,77 (1) :89~91
[15]卢雪梅,马登波.关于木素生物降解酶类活力测定问题的讨论[J],纤维素科学与技术,2002,2 (3~4) : 24~31
[16]徐惠生,黄秀瑜.稻草生物降解的研究[J].纤维素科学与技术,1999,1 (1) :12~22S
[17] Bachmann SL,McCauthy AJ.Purification and cooperative activity of enzymes the xylan-degrading system of Thermomonospora fusea [J].Appl Environ Microbiol,1999,57:2121~2130
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














