2.3.2 化学反应方向和限度的ΔG判据
2.3.2.1 吉布斯自由能
为了确定一个过程(或反应)的自发性,1876年,美国物理和化学家吉布斯(Gibbs J.W.)提出一个综合了体系焓变、熵变和温度三者关系的新的状态函数变量,并将其定义为:
G=H-TS (2.12)
式中的G称为吉布斯自由能或吉布斯函数。由于H、T和S都是状态函数,所以它们的组合G也是状态函数,具有加和性。
当一个系统从始态转化到终态时,系统的吉布斯自由能变化值为:
ΔG=G终-G始
热力学研究证明:对等温、定压且系统不做非体积功时发生的过程,若
(1)ΔG<0,过程正向自发进行。
(2)ΔG=0,体系处于平衡状态。
(3)ΔG>0,过程逆向自发进行。
由此可知,等温、定压下的自发过程,体系总是向着吉布斯自由能减少的方向进行。化学反应大多数在等温、定压且系统不做非体积功的条件下进行,因此可以利用过程的ΔG来判断化学反应能否自发进行。即等温、等压的封闭体系内,不做非体积功的前提下,任何自发过程总是朝着吉布斯自由能(G)减小的方向进行。ΔrGm=0时,反应达平衡,体系的G降低到最小值,此即为著名的最小自由能原理。
2.3.2.2 化学反应过程吉布斯自由能变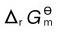 的计算
的计算
ΔG=G2-G1
=(H2-T2S2)-(H1-T1S1)
=(H2-H1)-(T2S2-T1S1)
当T2=T1=T时:ΔG=ΔH-T(S2-S1)=ΔH-TΔS (2.14)
则:ΔG=ΔH-TΔS
这就是吉布斯方程。
例2.9 试计算石灰石(CaCO3)在常温及1326K时,发生下列反应的自发性。
CaCO3(s)=CaO(s)+CO2(g)
4.根据吉布斯方程判断反应进行的方向 在恒定压力下,给定反应随选定温度不同,其反应方向也不同。如表2.3所示为等压条件下ΔrHm、ΔrSm及T对ΔrGm及反应方向的影响。
表2.3 等压条件下ΔrHm、ΔrSm及T对ΔrGm及反应方向的影响
注:*“高温”是指当T>ΔrHm/ΔrSm(ΔrSm>0)时。
另外根据吉布斯方程还可以确定化学反应在标准状态下的自发进行的转变温度。
例2.10 标态下,下列反应室温时可否自发进行?若不能自发进行,则其自发反应的最低温度为多少?
SiO(s)+3C(s)=SiC(s)+2CO(g)
解:SiO2(s)+3C(s)=SiC(s)+2CO(g)
此反应正向进行的最低温度为1571K。
2.3.2.3 化学反应吉布斯自由能变ΔrG的计算
实际中的很多化学反应常常是在非标准态下进行的。在等温等压及非标准态下,对任一反应来说:αA+βB→γC+δD
非标准状态下的自由焓变可由Van’tHoff等温方程式表示:
此式称为化学反应等温方程式,式中的Q为反应。
对于气体反应:
对于水溶液中的(离子)反应:
由于固态或液态处于标准态与否对反应的ΔrG影响较小,故它们在反应商Q式中不出现。
从上面讨论可以看出,改变温度可使反应自发进行的方向倒转,具体温度因反应而异。
【人物简介】
1.赫斯(HessG H,1802—1850) 生于瑞士日内瓦,任俄国圣彼得堡大学化学教授,从事无机化学研究。最著名的是他经过一系列热化学研究,于1840年从实验中发现,不管反应是一步还是多步进行的,化学中的热变化总是相同。现在称为恒定热总和的赫斯定律也是能量守恒定律,即热力学第一定律的直接结果,虽然当时赫斯并未认识到这一点。
2.约西亚·威拉德·吉布斯(Josiah Willard Gibbs,1839—1903) 美国物理化学家、数学物理学家。他奠定了化学热力学的基础,提出了吉布斯自由能与吉布斯相律。1871年吉布斯成为耶鲁学院教授,1876年在康涅狄格科学院学报上发表了奠定化学热力学基础的经典之作《论非均相物体的平衡》的第一部分,1878年完成了第二部分。这一长达300余页的论文被认为是化学史上最重要的论文之一,其中提出了吉布斯自由能、化学势等概念,阐明了化学平衡、相平衡、表面吸附等现象的本质。
【阅读材料】
常见能源及其清洁利用
一、能源的概述
能源是指提供能量的自然资源。能源的消费水平在很大程度上是一个国家综合实力的表现。
存在于自然界,可直接获得而无须改变其形态和性质的能源称为一次能源,亦称天然能源。其中风能、水能、太阳能、地热能、生物能、潮汐能等不会随着人们的使用而减少,称为可再生能源。而矿物能源如煤炭、石油、核燃料等,有些已经出现资源枯竭的危险,这些能源称为非再生能源。由一次能源经加工、转换或改质而得到的另一类型能源产物,称为二次能源,如电能、氢能、汽(煤)油等。
二、几种主要的能源
1.太阳能(solar) 太阳能一般指太阳光的辐射能量。在太阳内部进行的由“氢”聚变成“氦”的原子核反应,不停地释放出巨大的能量,并不断向宇宙空间辐射能量,这种能量就是太阳能。
太阳能是地球上主要能源的总来源,地球上的风能、水能、海洋温差能、波浪能和生物质能,以及部分潮汐能都来源于太阳;即使是地球上的化石燃料,如煤、石油、天然气等,从根本上说也是远古以来贮存下来的太阳能。所以,广义的太阳能所包括的范围非常大,狭义的太阳能则限于太阳辐射能的光热、光电和光化学的直接转换。
2.石油(petroleum) 石油又称原油,是从地下深处开采的棕黑色可燃黏稠液体,主要是各种烷烃、环烷烃、芳香烃的混合物。它是古代海洋或湖泊中的生物经过漫长的演化形成的混合物,与煤一样属于化石燃料。一般是暗褐色到绿色,有时发出荧光,能从中提取汽油、煤油、柴油、润滑油、石蜡、沥青等。石油被称为工业的血液。
石油由于热值比煤高而且开采、运输均较容易,实用性也强,用途广泛,占据能源消费的首位,是世界上最重要的动力燃料与化工原料。石油及其产品广泛用于生产和生活的各个方面。
3.天然气(natural gas) 天然气是埋藏在地下的古生物经过亿万年的高温和高压等作用而形成的可燃气,是一种无色、无味、无毒,热值高,燃烧稳定,洁净环保的优质能源。天然气的主要成分是甲烷,热值为8500大卡,是一种气态化石燃料。它主要存在于油田和天然气田,也有少量出于煤层。
与煤炭、石油等能源相比,天然气在燃烧过程中产生的能影响人类呼吸系统健康的物质极少,产生的二氧化碳仅为煤的40%左右,产生的二氧化硫也很少。天然气燃烧后无废渣、废水产生,具有使用安全、热值高、洁净等优势。
4.煤炭 煤是由远古时期繁茂植物的残骸累积随地层变动埋入地下,经漫长时间的地热高温、高压和细菌作用逐步形成的。煤是地球上储量最多的化石燃料,全世界的总储量估计有13万亿吨,它也是化学工业的重要原料。煤主要有泥煤、褐煤、烟煤和无烟煤,其煤化程度依次增高。煤是一种具有高碳氢比的复杂混合物,其可燃成分主要是碳和氢。
(1)水煤气:煤的汽化是有控制地将氧或含氧化合物(如H2O、CO2等)通入高温煤炭(焦炭层或煤层)发生有机物的部分氧化反应,从而获得含有H2、CO等可燃气体的过程。这些气体既可作为气体燃料,也可作为化工原料。根据所用汽化剂和所得产物的不同,可燃气体大致可分为:空气煤气、混合煤气、水煤气和半水煤气。
(2)合成气:合成气是以氢气、一氧化碳为主要组分供化学合成用的一种原料气。
主要以氧气加水蒸气作为汽化剂的方法,将纯氧气和水蒸气在加压下通过灼烧的煤,可使煤中的苯、酚(C6H5OH)等挥发出来,并生成一种气态燃料混合物,其体积分数约为40%H2、15%CO、15%CH4和30%CO2,称之为合成气。此方法不仅可直接用煤而不用焦炭,且可连续进行。
合成气由含碳矿物质如煤、石油、天然气及焦炉煤气、炼厂气等转化而得。按其的不同来源、组成和用途,它们也可称为煤气、合成氨原料气、甲醇合成气(见甲醇)等。合成气的原料范围极广,生产方法甚多,用途不一,组成(体积%)有很大差别:H 32~67、CO 10~57、CO 2~28、CH 0.1~14、N 0.6~23。
(3)煤的液化:煤的液化主要指煤催化加氢液化,其主要任务是将煤中的H/C原子比调整至合适的数值。在煤加氢的转化过程中,催化剂扮演了重要角色,Co、Ru、Pd、Pt、Rh等过渡金属配合物都是煤和煤衍生液体的催化剂。目前最常用的催化剂是载在多孔氧化铝表面上用硫化物处理过的钼酸钴,对于煤裂解的各种产物的加氢非常有效,并且在含有杂质原子的煤衍生液体中寿命相当长。
5.氢能(hydrogen energy) 氢能是指以氢及其同位素为主体的反应中或氢状态变化过程中所释放的能量,包括氢核能和氢化学能。
氢能源的开发应用必须解决三个关键问题,即廉价氢的大批量制备、氢的储运和氢的合理、有效利用。
(1)制备:工业规模化制氢有水煤气法、天然气或裂解石油气制氢;研究的方法有:电解水法、热化学分解水法、光分解和光电化学分解水法。
(2)输送与贮存:加压气态储存、深冷液化储存、金属氢化物储氢。
(3)氢化学能的利用:宇航推进剂、燃氢飞机等。
三、我国的能源状况
自古以来,我国一直以薪柴作为燃料。近代的中国城市以煤炭和木柴为主要能源,广大农村则主要靠秸秆和柴草为生活能源。
我国能源资源总量十分丰富,资源品种也较齐全,但是由于我国人口众多,人均能源资源占有量仅为世界平均水平的50%;另外,我国能源分布极不均衡,工业较发达的东南沿海地区煤炭和水力资源短缺。丰富的水力资源主要在西南交通不便和地形复杂的地区,开发利用难度较大。
我国一次能源以燃煤为主,1992年能源生产中煤炭10.7万亿吨,占总能源的74.3%;原油占18.9%,天然气占2.0%,水电占4.8%,这一基本情况近期不会有明显改变。
由于我国煤炭的灰分和硫分较高,原煤入洗率较低,大部分原煤未经洗选就直接燃烧,因此历年来我国工业和民用燃料排放悬浮颗粒物和二氧化硫数量极大,我们面临的大气保护和治理的任务是十分艰巨的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















