当某一金属离子既参与生成沉淀的反应,又参与生成配合物的反应时,沉淀剂与配合剂共同争夺金属离子,配合平衡与沉淀-溶解平衡会相互影响。例如,AgCl沉淀在氨水中溶解生成[Ag(NH3)2]+的过程可示意为:
沉淀-溶解平衡 AgCl(s)■■■Ag++Cl—
配合平衡 Ag++2NH3■■■[Ag(NH3)2]+
总反应 AgCl(s)+2NH3■■■[Ag(NH3)2]++Cl—
总反应的平衡常数表达简写式为:
将上式右边分子、分母同乘以ceq(Ag+),则

即沉淀的K■sp越大,或生成配离子的K■稳越大,沉淀越易溶解生成配离子。当然,反应进行的程度还与溶液中c(NH3)和c(Cl—)等有关。又如,在含有[Ag(NH3)2]+的溶液中加入KBr溶液,生成AgBr沉淀的过程可表示如下:
配合平衡 [Ag(NH3)2]+■■■Ag++2NH3
沉淀-溶解平衡 Ag++Br—■■■AgBr(s)
总反应 [Ag(NH3)2]++Br—■■■AgBr(s)+2NH3
总反应的平衡常数表达简写式为:
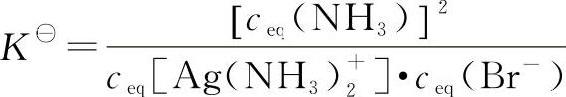
将上式右边分子、分母同乘以ceq(Ag+),则
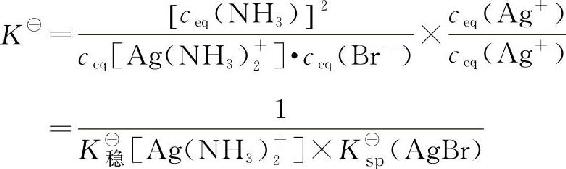
即配离子的K■稳越小,或生成沉淀的K■sp越小,配离子越易解离而生成沉淀。同样,反应进行的程度还与溶液中c(NH3)和c(Br—)等有关。
【例9-2】计算AgCl在6mol·L—1氨水中的溶解度(mol·L—1)。{K■sp(AgCl)=1.8×10—10,K■稳[Ag(NH3)2+]=1.1×107}
解:设AgCl在该氨水中的溶解度为xmol·L—1,
AgCl(s)+2NH3■■■[Ag(NH3)2]++Cl—
相对平衡浓度6—2xxx
该反应的平衡常数
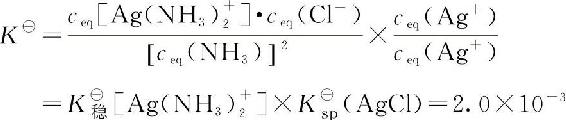
将相对平衡浓度代入平衡常数表达式,得
解得x=0.25mol·L—1
【例9-3】在1L6mol·L—1的NH3水中加入0.1mol固体CuSO4,溶解后再加入1×10—3 mol固体Na2S,是否有CuS沉淀生成?{设溶液体积不变。已知K■sp(CuS)=6.3×10—36,K■稳[Cu(NH3)24+]=2.1×1013}
解:设NH3与CuSO4反应后,溶液中ceq(Cu2+)=x,则
4NH3+Cu2+■■■[Cu(NH3)4]2+
相对平衡浓度 (6—0.1×4)+4xx 0.1—x
因[Cu(NH3)4]2+的解离受到过量NH3的抑制,(6—0.1×4)+4x≈(6—0.1×4),0.1—x≈0.1。故
解得 x=4.8×10—18 故ceq(Cu2+)=4.8×10—18mol·L—1
已知加入Na2S后,溶液中c(S2—)=1×10—3mol·L—1,可得
c(Cu2+)×c(S2—)=4.8×10—18×1×10—3=4.8×10—21>K■sp(CuS)=6.3×10—36所以有CuS沉淀生成。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














