(一)稳定常数和不稳定常数
各种配离子的稳定性相差很大。有的配离子只有在大量配体存在下才能稳定存在,如难溶的AgCl可在浓盐酸中形成[AgCl2]—而溶解,但溶液一稀释,又沉淀出AgCl。而有的配离子在水溶液中很稳定,如[Fe(CN)6]3—,其水溶液中难于检出CN—,加浓碱也不产生难溶的Fe(OH)3沉淀。如何衡量配合物的稳定性呢?
在CuSO4溶液中加入过量的氨水,会生成[Cu(NH3)4]2+离子。若在此溶液中加入稀NaOH溶液,没有Cu(OH)2沉淀生成,但加入Na2S时则有黑色沉淀(CuS)生成。这表明溶液中存在一定量的Cu2+离子,即Cu2+并没有被完全结合成[Cu(NH3)4]2+。按化学平衡的观点,Cu2+与NH3生成[Cu(NH3)4]2+的反应具有一定程度的可逆性,即[Cu(NH3)4]2+的生成反应与解离反应最后会达到平衡。因此,将配合物或配离子在溶液中存在的生成与解离的平衡称为配合平衡。如[Cu(NH3)4]2+的配合平衡:
Cu2++4NH3■■■[Cu(NH3)4]2+
【配离子的总生成反应的平衡常数称为稳定常数(stabilityconstant),用K■稳表示】。如上述[Cu(NH3)4]2+的稳定常数表达简写式为:
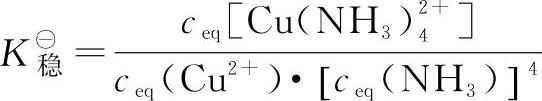
显然,稳定常数可以衡量配合物的稳定性。稳定常数越大,表明配离子生成的趋势越大,而解离的趋势越小,即在溶液中越稳定。一些常见配离子的稳定常数见表9-1。
除稳定常数外,还可以用不稳定常数来表示配离子在溶液中的稳定性。配离子的总解离反应的平衡常数称为不稳定常数(instabilityconstant),用K■不稳表示。如

显然,K■稳和K■不稳互为倒数,即

表9-1 一些常见配离子的稳定常数K■稳(293~298K)
应当注意,配离子类型相同时,稳定常数越大,配离子越稳定。如[Ag(NH3)2]+、[Ag(S2O3)2]3—和[Ag(CN)2]—是同类型的(1∶2型),稳定常数依次增大,它们的稳定性也依次增大,可参见例10-1。如果配离子类型不同,只能通过计算结果来比较它们的稳定性,若直接由K■稳的大小来比较,往往会得出错误的结论。
【例9-1】分别计算:(1)在0.1mol·L—1[Ag(NH3)2]+溶液中含有0.1mol·L—1的氨水时和(2)在0.1mol·L—1[Ag(S2O3)2]3—溶液中含有0.1mol·L—1的S2O23—离子时,溶液中Ag+离子的浓度。
解(1)设在[Ag(NH3)2]+和氨水的混合溶液中,ceq(Ag+)=x,则
Ag++2NH3■■■■■[Ag(NH3)2]+相对平衡浓度x 0.1+2x 0.1—x
有大量氨水存在时,[Ag(NH3)2]+的解离受到抑制,可设0.1+2x≈0.1,0.1—x≈0.1。
故

解得 ceq(Ag+)=x=9.1×10—7mol·L—1
(2)设在[Ag(S2O3)2]3—和S2O23—的混合溶液中,ceq(Ag+)=y,与上述(1)的计算相似,则
Ag++2S2O23—■■■■■[Ag(S2O3)2]3—
相对平衡浓度

解得ceq(Ag+)=y=3.4×10—13mol·L—1
上述计算结果表明,在水溶液中[Ag(S2O3)2]3-比[Ag(NH3)2]+较难解离,即[Ag(S2O3)2]3—较稳定。需指出,只有在大量配体存在时才可按例10-1的方法计算配离子溶液中金属离子的浓度,否则不能按此方法。例如,在0.1mol·L—1[Ag(NH3)2]+溶液中,没有过量NH3存在时,因配离子的逐级解离,溶液中ceq(Ag+)≠2ceq(NH3)。此外,上述计算忽略了金属离子的水解和配体的水解或电离。
(二)逐级稳定常数和累积稳定常数(自学)
配离子在溶液中的生成或解离是分步进行的。例如[Cu(NH3)4]2+的生成分四步进行:

【每一步配离子生成反应的平衡常数称为逐级稳定常数】。如上述K■1、K■2、K■3和K■4。显然,第一步解离反应的平衡常数等于1/K■4,第二步解离反应的平衡常数等于1/K■3,其余类推。单核配离子的逐级稳定常数通常是逐渐减小的,即K■1>K■2>K■3>K■4…,并且与多元弱酸的电离平衡常数相比,各相邻的逐级稳定常数之间一般相差较小。
此外,还常用累积稳定常数(β■i)来表示配合平衡关系。【累积稳定常数是某一级配离子的总生成反应的平衡常数】。例如:
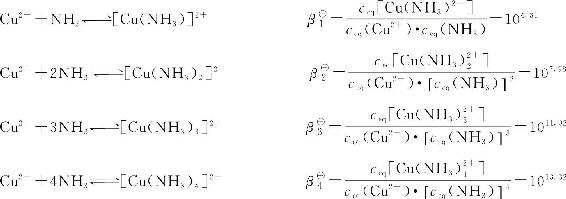
根据多重平衡原理,逐级稳定常数和累积稳定常数之间存在一定的关系。以[Cu(NH3)4]2+为例,则:
β■1=K■1,β■2=K■1·K■2,β■3=K■1·K■2·K■3,β■4=K■1·K■2·K■3·K■4由此可得下列关系:
附录八中列出了一些配离子的稳定常数(以lgβ■n表示)。查阅时应注意lgβn■与lgK■稳之间的关系。例如,Cu2+与NH3生成配离子反应的lgβ■4=13.32,lgβ■5=12.86,表明[Cu(NH3)4]2+继续与NH3结合生成[Cu(NH3)5]2+的平衡常数K■5很小,即[Cu(NH3)5]2+相对不稳定,因此铜氨配离子通常写为[Cu(NH3)4]2+,lgK■稳=lgβ■4=1332。其他配离子情形相近。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














