价层电子对互斥理论可以预测多原子分子的空间构型,而且该理论直观简单,但是它不能很好地说明键的形成。价键理论成功地阐明了共价键的本质和特性,但是在解释多原子分子的空间构型方面却遇到了一些困难。Pauling在价键理论的基础上,提出了杂化轨道理论(hybrid orbital theory),进一步补充和发展了价键理论,并且成功地解释了多原子分子的空间构型。
(一)杂化轨道理论的基本要点
杂化轨道理论认为:【原子在形成分子时,由于原子间相互作用的影响,同一原子中若干不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道,这种重新组合的过程称为杂化(hybridation),所形成的新的原子轨道称为杂化轨道(hybrid orbit)】。
其基本要点如下:
1.只有能量相近的原子轨道才能进行杂化。杂化只有在形成分子的过程中才会发生,而孤立的原子是不可能发生杂化的。常见的杂化方式有ns-np杂化,ns-np-nd杂化和(n—1)d-ns-np杂化。
2.杂化轨道成键时,要满足化学键间最小排斥原理。键与键间排斥力的大小决定于键的方向,即决定于杂化轨道间的夹角,故杂化轨道的类型与分子的空间构型有关。
3.杂化轨道的成键能力比原来未杂化的轨道的成键能力强,形成的化学键的键能大。因为杂化后原子轨道的形状发生变化,电子云分布集中在某一方向上,比未杂化的s、p、d轨道的电子云分布更为集中,重叠程度增大,成键能力增强,如图2-10所示。
图2-10 sp杂化轨道形成示意图
4.n个原子轨道杂化形成n个杂化轨道,杂化轨道的数目等于参加杂化的原子轨道的总数。
(二)杂化轨道的类型
根据原子轨道种类和数目的不同,可以组成不同类型的杂化轨道,通常分为等性杂化和不等性杂化。
1.等性杂化
【完全由一组具有未成对电子的原子轨道或者是空轨道参与杂化而形成的简并杂化轨道的过程称为等性杂化】。例如下面所提到的sp3、sp2和sp等性杂化。
(1)sp3杂化 同一个原子内由一个ns轨道和三个np轨道参与的杂化称为sp3杂化,所形成的四个杂化轨道称为sp3杂化轨道。sp3杂化轨道的特点是每个杂化轨道中含有1/4的s成分(能量)和3/4的p成分,杂化轨道间的夹角为109°28′,空间构型为四面体形。
气态CH4分子中的C原子属于sp3杂化。基态C原子的最外层电子构型是2s22p2,在H原子的影响下,C原子的一个2s电子激发进入一个2px轨道中,使C原子取得2s12p1x2p1y2p1z的结构,即

其一个2s轨道和三个2p轨道进行sp3杂化,形成四个能量相等的sp3杂化轨道,每个sp3杂化轨道中有一个未成对电子,它们分别与四个H原子的含有未成对电子的1s轨道重叠形成四个σ键,由于C原子的四个sp3杂化轨道间的夹角为109°28′,所以生成的CH4分子的空间构型为正四面体形,如图2-11所示。
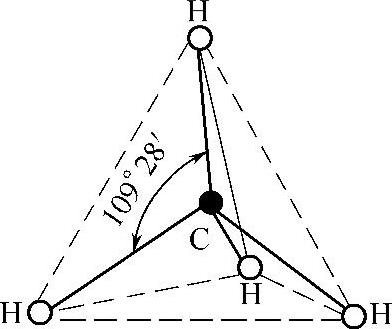
图2-11 CH4分子构型

图2-12 BF3分子空间构型
(2)sp2杂化 同一个原子内由一个ns轨道和两个np轨道参与的杂化称为sp2杂化,所形成的三个杂化轨道称为sp2杂化轨道。每个sp2杂化轨道中含有1/3的s轨道成分和2/3的p轨道成分,杂化轨道间的夹角为120°,空间构型呈平面正三角形。
例如气态BF3分子中B原子属于sp2杂化,基态B原子最外层电子构型是2s22p1,在F原子的影响下,B原子的一个2s电子激发进入一个空的2p轨道中,使B原子取得了2s12p1x2py1

其一个2s轨道和两个2p轨道进行sp2杂化,形成三个能量相等的sp2杂化轨道,每个sp2杂化轨道中含有一个未成对电子,它们分别与三个F原子含有未成对电子的3p轨道重叠形成三个σ键,夹角为120°,BF3的分子空间构型为平面三角形。如图2-12所示。
(3)sp杂化 同一个原子内由一个ns轨道和一个np轨道参与的杂化称为sp杂化,所形成的轨道称为sp杂化轨道。每一个sp杂化轨道中含有1/2的s轨道成分和1/2的p轨道成分,两个杂化轨道间的夹角为180°,空间构型呈直线形。
例如气态的BeCl2分子的结构,Be原子的电子结构是1s22s2,在Cl原子的影响下,Be原子的一个2s电子可以激发进入一个空的2p轨道中,使Be原子取得2s12px1的结构,其一个2s轨道和一个2p轨道进行sp杂化,形成二个sp杂化轨道,每个杂化轨道中有一个未成对电子。Be原子用两个sp杂化轨道分别与两个Cl原子含有未成对电子的3p轨道进行重叠,形成两个σ键,键的夹角为180°,分子的空间构型为直线型。
(4)其他类型的杂化
表2-8 其他几种类型的杂化

2.不等性杂化NH 3 分子和H 2 O分子的结构
凡是【由于杂化轨道中有不参加成键的孤对电子对的存在,杂化后所得到的一组杂化轨道并不完全简并,这种杂化过程称为不等性杂化】,例如NH3分子和H2O分子中的N原子和O原子分别采取的sp3不等性杂化。
NH3分子中基态N原子的最外层电子构型是2s22p1x2p1y2p1z,在H原子影响下,N原子的一个2s轨道和三个2p轨道进行sp3不等性杂化,形成四个sp3杂化轨道。其中三个sp3杂化轨道中各有一个未成对电子,另一个sp3杂化轨道为一对孤对电子所占据。N原子用三个各含一个未成对电子的sp3杂化轨道分别与三个H原子的1s轨道重叠,形成三个N—H键。由于孤对电子的电子云密集在N原子的周围,对三个N—H键的电子云有较大的排斥作用,使N—H键之间的夹角被压缩到107°18′,因此NH3分子的空间构型为三角锥形,如图2-13所示。
H2O分子中基态O原子的最外层电子构型为2s22p4,在H原子的影响下,O原子采取sp3杂化,形成四个sp3杂化轨道。其中两个杂化轨道中各有一个未成对电子,另外两个杂化轨道分别为孤对电子所占据。O原子用两个各含有一个未成对电子的sp3杂化轨道分别与两个H原子的1s轨道重叠,形成两个O—H键。由于两对孤对电子对两个O—H键的成键电子有更大的排斥作用,使O—H键之间的夹角被压缩到104°45′,因此水分子的空间构型为角形,如图2-14所示。

图2-13 NH3分子的结构
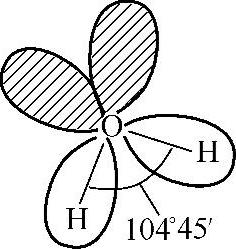
图2-14 H2O分子的结构
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














