克隆性是植物生长繁殖活动中的一个普遍现象,是自然生态系统的重要组成部分,几乎存在于所有的生态系统类型中,发挥着其独特的作用。目前建立在个体水平和种群水平基础之上的克隆植物群落的研究已成为克隆植物生态学研究的重要课题(宋明华等,2002)。在克隆植物种群的建立及发展过程中,由于存在着不同的生长特性,使得不同克隆植物种群具有不同结构和分布特征,其中有一种类型表现为斑块状分布。斑块是由克隆植物的不同基株经无性繁殖形成的一个个密集群体,多数斑块间会有明显的距离分隔。克隆植物斑块的建成和发展与该种群的生态适应能力密切相关,斑块现象在群落中的出现影响着整个群落的组成及群落的格局与动态,最终影响着某一区域生态群落的整体功能,因此克隆植物具有的斑块状分布问题已引起了许多研究者的兴趣(Kreher et al.,2000;Torimaru et al.,2003)。
地椒主要分布于长江以北的干旱及半干旱山区及草地,尤其在许多土壤退化及风化严重的生境脆弱地区,可成为自然的优势植物种或单优群体,在群落组成及生态演替中发挥着重要的功能。Sotomayor(1998)研究认为百里香属植物在土壤环境荒漠化进程中的群落组成方面有着突出表现。这一方面是因为百里香属植物具有较强的抗逆性,另一方面也与其本身所具有的广泛生态多样性及其克隆生长特性有关。百里香是一种兼性克隆植物,有性繁殖主要以虫媒为主,克隆繁殖过程主要是从地上部分匍匐枝的茎节处产生不定根,然后经过冬季地上部分枯死,来年条件合适时再在不定根处萌发形成新的无性系。野外调查发现,百里香种群常以斑块形式分布,这些斑块间所具有的多样性差异及空间分布特点,会对整个居群的建立、扩张及空间结构的形成造成一定的影响(Chung et al.,1999)。本试验点选择在中国百里香属植物地椒分布区最南端的安徽怀远县城东南方向淮河岸边的涂山分布点上,通过实地考察我们发现,此样点为地椒在该区域的孤立分布点,即使在周围其他完全相同的生境范围内也均未见有分布,因此对该区域地椒种群的研究将为探明该物种在生态进化中的意义及其地理分布规律提供很好的理论依据。我们通过对野生地椒植物斑块多样性、克隆结构及空间格局分布的研究,探讨该地区特定生境下野生地椒种群的斑块建立及更新特点,揭示其繁殖机制及生态适应性规律,为研究地椒种群动态变化和进化机理以及如何保持其生态功能的稳定性提供重要的理论基础。
利用ISSR及SRAP分子标记技术,对分布在最南端的3个地椒怀远居群进行了以斑块为单位的遗传多样性,克隆多样性和克隆结构、空间结构的初步研究,以更好地揭示野生地椒种群斑块的形成及基于斑块的种群扩张机理。本研究表明,地椒野生居群内存在较高的遗传多样性(多样性条带百分率为61.42%,Nei’s基因多样性指数为0.2149,Shannon信息多样性指数为0.3188),同时也具有较高的克隆多样性水平(基因型比率平均为0.61,Simpson指数平均为0.96,Fager均匀性指数平均为0.91),多样性水平较高的原因可能是奠基者效应和种苗多次重复补充效应共同作用的结果。居群间的遗传分化较低,总的遗传多样性中的90.35%来自居群内不同斑块间的变异,居群间的变异仅占9.65%,说明在该地区地椒不同居群间存在着大量的基因流。对克隆结构的分析表明,本区域野生地椒不同居群间无共有基因型斑块,不同斑块之间在分布上具有一定范围内的镶嵌性,克隆斑块间的分布范围主要集中在0~25m,这是地椒植物兼有的游击型生长和密集型生长的特性决定的。从空间自相关分析看,该地区地椒居群除了在部分位点上表现出一定相关规律外,总体居群缺乏空间结构,其居群内不同斑块间为随机分布。综合以上研究初步认为,怀远地椒种群在斑块建立之初应为种子的入侵与繁殖造成的,其后斑块的发展及种群的扩张应该是以有性繁殖为主,克隆繁殖与有性繁殖共同作用的结果。
一、材料和方法
(一)供试材料
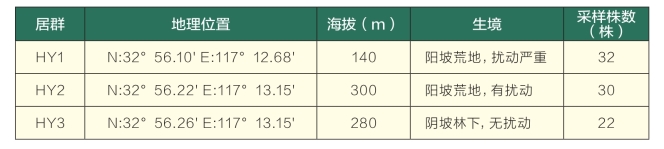
供试材料为地椒,采集地点位于安徽省怀远县城东南方向淮河岸边涂山上,为中国秦岭—淮河自然地理南北分界线,野外考查认为该点是目前中国地椒资源的最南端分布点。采集地气候条件为亚热带大陆湿润季风气候,年平均温度16.1 ℃,极端最低温度-6.5 ℃,极端最高温度37.7 ℃,年平均无霜期195 d,年平均日照2200 h,年平均降水量低于912.2mm。本试验于2007年8月分别在涂山上选择3个生态样点:HY1、HY2、HY3(表1),其中HY1、HY2样点面积为100m×100m,以5m×5m的面积采集一个斑块中的单株,并对HY2样点进行了采样位置定位,由于HY3样点的地椒分布稀少,无法拉样方,仅在相邻斑块间连续采集样株并标定采集位置,所有采样距离均超出5m。采摘幼嫩茎端叶片,放入变色硅胶密封后带回,充分干燥后密封存放于-70 ℃冰箱中待用。
表1 地椒野生居群采样点情况
(二)引物的筛选及PCR扩增
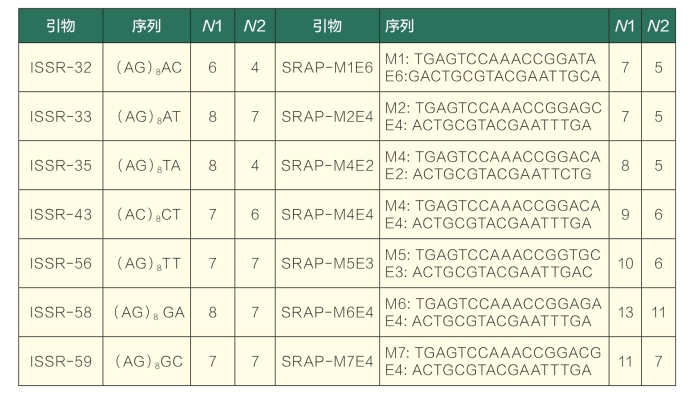
参考美国哥伦比亚大学和UBC公司公布的ISSR引物序列合成90个引物,SRAP引物参考Li等(2001)发表的引物序列,选择合成了正端和负端引物各7条,共组合形成49对引物(引物均由上海英骏生物公司合成),对以上引物进行筛选,从中选出扩增片段清晰、条带数目较多的12条ISSR引物和12对SRAP引物,用筛选出的引物对所有供试单株进行扩增比较,又从中选择出多态性较高、重复性较好的9个ISSR引物和7对SRAP引物扩增结果进行条带的统计及数据分析,引物序列及检测的位点数统计见表2。
表2 引物序列及条带统计
(续表)
注:N1表示所得条带数;N2表示多态性条带数
(三)数据统计分析
由于ISSR和SRAP均为显性分子标记,故将数据作为单倍型数据进行统计,在某一位点上依据条带的有或无分别记为1或0,输入Excel表中形成二元数据矩阵。在此数据基础上进行如下统计分析。
(1)多样性的分析:运用POPGENE Version 1.3.1软件计算地椒各居群间及居群内全部个体多态位点百分率、居群总基因多样性、居群内基因多样性、居群间的遗传分化指数、Nei’s 基因多样性指数、Nei’s 遗传距离和遗传一致度及Shannon信息多样性指数,并对居群间及居群内斑块间进行聚类分析。采用Arlequin Version 3.01软件包进行AMOVA分析,计算居群内、居群间的变异方差分布。另外通过比较分子数据计算出每个居群实际基因型(基株)总数(G)、平均克隆大小Nc(N/G)(N为取样个体数)、基因型比率PD(G/N)、Simpson多样性指数(D)(Parker et al.,1992)和Fager指数(E)(Fager,1972)。其中将所有扩增位点谱带完全相同的个体视为同一克隆(即基因型相同)。采用NTSYS软件对不同标记统计获得的遗传距离矩阵进行Mantel检测,判断不同标记间的一致性。
(2)空间自相关分析:参考李作洲(2003)等的方法,以HY2居群为例,将每个个体的分子统计数据和空间定位数据相结合进行地椒居群的空间自相关分析,为保证记载数据具有足够的统计学意义,在每一个被分析居群中,统一选取了表型频率在25%~75%的位点用于分析,采用等间隔地理距离等级(10个等级)方法计算不同距离等级下的Moran’s I空间自相关系数和期望值,距离梯度的设置按个体间的平均距离设置,采用SAAP 4.3计算机软件进行数据处理,分析HY2居群的空间自相关性。
二、结果与分析
(一)地椒居群遗传多样性及遗传结构分析
通过9条ISSR引物和7对SRAP引物对3个野生地椒居群斑块的84个个体进行扩增,共扩增出85个清晰的、易于统计的位点,其中多态性位点64个,多态位点百分率达75.29%。其中ISSR扩增条带范围主要在300~1500 bp之间,SRAP标记的扩增条带范围主要在150~300 bp之间,部分扩增结果见图1、图2。POPGENE 结合AMOVA软件分析的数据结果表明(表3):在斑块水平上的Nei’s基因多样性指数为0.2537,Shannon信息多样性指数为0.3811;居群间的Nei’s基因多样性指数为0.2149,Shannon信息多样性指数为0.3188,且两个参数在不同居群间的变化趋势相一致,其大小均为HY1 > HY2 > HY3。居群总的基因多样度为0.2547,居群内不同斑块间基因多样度为0.2331,居群间的基因多样度为0.0236,遗传分化系数为0.0847,总的遗传变异中的90.35%发生在居群内不同斑块间,居群间的变异仅占9.65%,居群内及居群间的变异均达到极显著水平(P < 0.001)。居群间的遗传一致度平均达到95.87%,根据Nei’s遗传距离对3个居群进行聚类,HY1和HY2居群聚在一起。

图1 引物ISSR-33对HY2居群30个样品的ISSR-PCR扩增结果
注:Marker为2000 bp DNA分子量标准

图2 引物SRAP-M5E3对HY2居群30个样品的SRAP-PCR扩增结果
注:Marker为500 bp DNA分子量标准
表3 地椒居群遗传变异参数统计
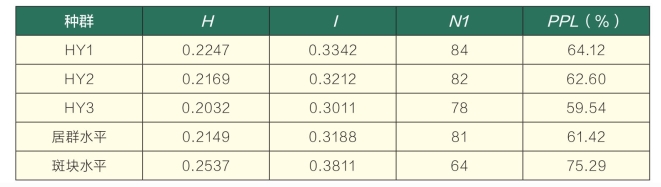
注:H表示Nei's基因多样性指数;I表示Shannon信息多样性指数; N1表示总多态位点数;PPL表示居群多态位点百分率
(二)地椒居群克隆多样性及克隆空间结构分析
从统计分析结果可以看出(表4),3个地椒居群均为多克隆居群,供试的84个个体包含52种基因型,基因型比率为61%,其中HY3居群的基因型比率明显低于HY1和HY2居群,同一基因型多数只包含2~3个无性株,斑块的平均克隆大小为1.65,Simpson克隆多样性指数平均为0.96,其中HY2、HY1居群稍高于HY3居群,但总体平均值都远远高于许多克隆居群的平均值,3个居群的Fager均匀性指数均达到0.9。对全部个体的聚类分析表明,同一居群个体分别聚在一起,未出现居群间交叉,不同居群间无共有基因型,在不同居群内部均无显著的竞争优势克隆存在。从HY2居群的空间分析初步得出,该居群内的10个克隆株超过1株的基株,其无性株(斑块)间的平均空间距离为12m左右,最远距离可达25m左右,同一克隆斑块间少数为相邻分布,大多呈镶嵌状分布,其空间样点分布见图3。
表4 怀远野生地椒克隆结构分析
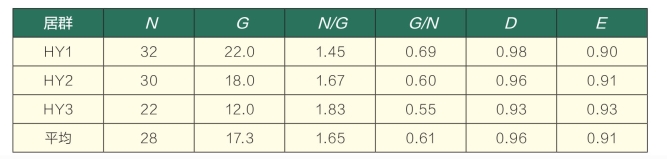
注:N表示样本数;G表示基株数;N/G表示平均克隆大小;G/N表示基因型比率;D表示Simpson克隆多样性指数;E表示Fager均匀性指数

图3 HY2居群克隆空间分布图
注:▲表示采样斑块;同一数字代表同一克隆
(三)地椒空间自相关分析
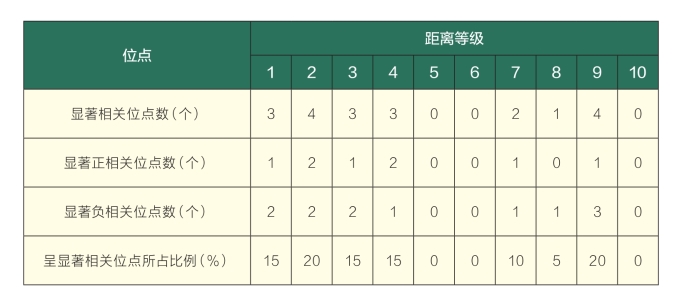
运用空间自相关分析对HY2居群内不同斑块进行研究,判断该居群内遗传及克隆变异的分布特征。空间自相关分析是一种用来检测与量化从多个标定点中取值变异的空间依赖性的方法,它通过检测一个位置上的变异是否依赖于邻近位置的变异,来判断该变异是否存在空间自相关性,即是否存在空间结构(何敬胜等,2005;何田华等,1999;李作洲等,2003)。本试验对HY2居群以个体间的采样平均距离5.9m为梯度,分别划分10个距离等级,在计算出的300个Moran’s I值中,仅有20个(6.7%)达0.05显著水平(表5),主要集中在1~4(0~23.6m)的距离等级内(表6),在这一等级距离内的总体显著相关位点占所有等级距离内位点比例的65%,其中第2等级的显著性位点比例达20%。以上结果说明在地椒居群内的斑块空间分布除了在部分位点表现一定相关规律外,总体居群缺乏空间结构,其居群内不同斑块间更多地表现为一种随机分布方式,对显著性位点的进一步分析可以看出,多数位点表现出一种斑块分布模式。
表5 HY2居群10个距离等级下的Moran’s I值及其显著性(等距离间隔)

(续表)

注:*表示P < 0.05水平上差异显著,**表示P < 0.01水平上差异显著; 1,0~5.9m;2,5.9~11.8m;3,11.8~17.7m;4,17.7~23.6m;5,23.6~29.5m;6,29.5~35.4m;7,35.4~41.3m;8,41.3~47.2m;9,47.2~53.1m;10,53.1~59m
表6 HY2居群各距离等级中表现出显著相关的位点数(等距离)
三、讨论与小结
(一)ISSR及SRAP两种标记合并分析的可行性
将不同分子标记技术合并分析的研究已见部分报道。SRAP和ISSR标记虽然基于不同的扩增原理,但两者都为共显性标记,数据统计及分析处理过程一致。本研究数据分析结果表明两种标记所揭示的基因型差异较为相似,各自的遗传距离聚类图的基本模式比较一致,而且对ISSR及SRAP的遗传距离矩阵进行的Mantel检验表明,两者存在较高相关性(r=0.8864,t=2.8679,P<0.01)。基于以上原因,我们将两种分子标记数据进行了合并分析,以期更好地体现多样性检测的水平和试验结果的稳定性。对ISSR和SRAP标记合并后的遗传距离矩阵分别与两种标记结果进行的Mantel检验结果表明,彼此显著相关,相关系数分别为0.8937(P<0.01)和0.9019(P<0.01),因此将两种标记结果进行合并分析是可行的。
(二)地椒居群的多样性分析
对居群多样性的分析包括遗传多样性和克隆多样性两个方面,本研究中的3个地椒居群总的多态位点百分率达75.29%,个体水平上的Nei's基因多样性指数为0.2537,Shannon信息多样性指数为0.3811,基因型比率平均为61%,Simpson克隆多样性指数平均为0.96,远远高出Ellstrand(1987)等总结的克隆植物的克隆多样性平均值(PD=0.17,D=0.62),表明供试地椒居群在遗传多样性及克隆多样性水平方面均达到较高水平,也就是说即使是在克隆植物居群中也可以保持较高的多样性水平,这与许多前人的研究结果相似(陈媛媛等,2006;夏立群等,2002;Ellstrand et al.,1987;Kirsten et al.,1998)。本试验所选择样点处于中国地椒分布的最南端,野外考查发现地椒在这一地区的分布范围很小,仅在海拔100m以上的涂山有分布,其周围较大区域内均未见分布,呈现出明显的地理隔离,在这个很小区域范围内却存在如此高的遗传及克隆多样性必然是各方面因素导致的结果,分析原因主要是:(1)克隆植物局域克隆多样性取决于已有基因型的丧失和经由有性繁殖而来的新基因型补充之间的平衡(沈栋伟等,2007),根据试验分析及野外考查,推测该区域野生地椒居群的种苗补充机理是一种种群发展过程中的种苗重复补充(阮成江等,2005;Ziegenhagen et al.,2003)模式,地椒是一种兼性克隆植物,该样点采集的种子在实验室的萌发率可达58%,因此可以通过有性繁殖补充遗传变异的损失,提高种群内的遗传变异水平并降低种群间的差异(Kirsten et al.,1998),同时较高的遗传多样性也就造成了其较高水平的克隆多样性。(2)奠基者效应在保持多样性方面起到一定作用。该地区地椒种群在形成之初可能拥有一个广泛连续分布且具丰富遗传基础的祖先,虽然随着人类活动的日益频繁以及生境的片断化不断加剧,形成了一些基因交流有限且不连续分布的居群,但在某个居群内部仍然保留着其祖先丰富的总体遗传多样性(Eriksson,1993),该地区地椒居群的分布很可能是很早以前大范围地椒居群因某种原因分隔后的一个分支,从目前地椒的野外考查看,造成其分隔的原因很可能是生态片段化与生态适应性选择共同作用的结果。(3)根据Kreher(2000)、Torimaru(2003)等人的研究,不同克隆植物斑块间及斑块内遗传多样性有着很大的差异,这与克隆植物本身的克隆生长策略、生存环境及个体突变能力等因素有关。地椒作为一种低矮的半灌木,属于游击型生长的克隆植物,但由于生长量较小,间隔子较短,同时分枝性较强,方向性较差,地上部分伸展扩充空间范围的能力有限,不同分株常密集生长在基株周围,在野外生长表现为明显的小斑块状分布,因而即使斑块内由于克隆生长存在较低的基因型比率,但在不同斑块间却可能存在着较高的个体间遗传差异,对相邻不同斑块间的取样结果就有可能导致斑块间较高的遗传及克隆多样性水平。另外,其他的一些因素如克隆植物基因型选择水平高低、散布方式和种群历史等都对克隆植物多样性水平有重要影响(夏立群等,2002;朱志红等,2007)。
(三)地椒居群的遗传及克隆结构分析
影响遗传结构的主要原因是基因流的大小,而基因流的大小与花粉扩散及种子传播的范围有关(Torimaru et al.,2003)。地椒的基因流主要是通过以昆虫为媒介引起的花粉迁移和风力及动物活动引起的种子传播而产生的。本研究中地椒居群每代个体的基因流为3.53,其遗传一致度达到95.87%,与Hamrick (1987)研究的16种动物传粉异交植物的平均基因流水平(平均为1.15)相比,地椒明显高于异花传粉植物的平均值,这表明该地区地椒居群间具有充分的基因流,且基因流较为频繁,从而造成居群间的遗传分化很小,遗传一致程度较高。当然这也与本地区野生地椒分布区域小,各个不同居群间地理距离较近有关。对克隆结构分析表明:地椒斑块间同一克隆所包含的基株数目较少,多数为2~3株,同一克隆斑块间的分布多集中在0~25m,这一范围内除少数为相邻分布外,大多为一种镶嵌分布,这说明野生状态下地椒的生长方式是一种游击型生长方式,但也具有密集型生长方式的特点,这与地椒的生长发育特性有关。地椒是一种低矮的小灌木,每年地上茎的生长量较小,地上部分茎的最大伸展范围可达50 cm,但大多数一年生枝长度小于30 cm,地椒地上茎多为丛生型萌发,茎节短而数目多,这些较多的地上匍匐茎在延长生长过程中,碰到合适的环境条件时,茎节处会产生大量不定根,这些具有不定根的匍匐茎,经冬季会枯死,来年春季从不定根处产生新的无性株,理论上讲,新的无性株会重复繁殖下去,但实际的世代无性繁殖过程中会受到如基株的死亡更新、微环境的异质性、生境的片段化等多重因子的阻碍而影响其斑块的扩张,从而造成斑块间的空间隔离和克隆斑块间分布面积和范围的差异。另外,从地椒不同居群多样性比较可以看出,3个居群均为多克隆居群,但HY3居群的基因型比率和Simpson克隆多样性指数明显低于HY1和HY2居群。可能是由于HY3居群处于山顶南坡,几乎无人为扰动,而HY1、HY2居群所处位置的人为扰动比较严重,也就是可以初步推断野生状态下地椒种群无性株在种群中所占比率比扰动严重的种群相对更高,无性繁殖能力更强,这与前人的研究结果一致。如果从环境因素和种群适应性方面考虑,虽然一定程度的扰动会造成空间分布的异质性程度增加,但如果其扰动并未影响到整体生境的可利用性,相反却有可能增加有性繁殖的补充更新机会,从而提高整体居群的多样性水平(张玉芬等,2006)。
(四)空间自相关分析
通过对HY2居群的空间自相关分析,其显著性相关Moran’s I 值比率只有6.7%,可以看出该地区野生地椒居群内不同斑块间的变异缺乏空间结构,表现为随机分布的空间模式,说明该居群形成之初应该是一个连续的大居群,并具有较均匀的分布。从显著性相关位点的分布可以看出,在第1~4距离等级(0~23.6m)中,显著性位点所占比例达65%,显著性位点分布均匀,正负Moran’s I值的数量差别不大,说明在该范围内差异显著或一致性显著的个体都有分布,这与我们调查的同一克隆斑块的分布范围(0~25m)较为一致。
(五)地椒种群建立及扩张机理初步推断
结合以上分析我们认为,地椒在斑块建立之初应为种子入侵与繁殖造成的,其后斑块的发展及种群的扩张应该是以有性繁殖为主,克隆繁殖与有性繁殖共同作用的结果。具体表现为,地椒种群在不同环境和不同世代的生态群落中,会采取以有性生殖保持遗传多样性和以克隆繁殖扩充斑块面积进而获得更大环境资源利用的群体策略,来使其种群得以建立并获得一定程度的扩张,由此可见斑块在后期地椒种群扩张中占有着重要的地位。斑块的大小、斑块的数量以及斑块间克隆结构的差异因生态因子整体的不同而有很大差异,最终造成群落整体表现的差异。因此在脆弱生境下人工建立和保护地椒种群时,前期在种群建立时,不宜以克隆繁殖方式进行,而应以有性繁殖(种子繁殖)为主,后期要注意保护其环境的稳定性,加强其植株克隆繁殖的能力,从而使斑块得以不断扩张,使种群得以发展。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















