第二节 蛋白质的化学组成
一、蛋白质的元素组成
蛋白质的组成因来源不同而有所差别,但从各种生物组织中提取的蛋白质都含有碳元素(50%~55%)、氢元素(6.0%~7.0%)、氧元素(11%~24%)和氮元素(15%~17%);大多数蛋白质还含有硫元素(0~4%);有些蛋白质含有磷元素;少数蛋白质还含有微量金属元素(如铁、铜、锌、锰等);个别蛋白质还含有碘元素。
各种蛋白质的含氮量十分接近且恒定,平均为16%,即100g蛋白质中含有16g氮,而每克氮相当于6.25g(即100/16)蛋白质。由于测定生物样品中含氮量比直接测定其中蛋El质量容易得多,因此,只要测出样品中的含氮量,按下式就可以计算出生物样品中蛋白质的大致含量:
每克样品中蛋白质的含量=每克样品中含氮量×6.25
测定蛋白质分子中的含氮量一般采用微量凯氏定氮法。
二、蛋白质的氨基酸组成
氨基酸是蛋白质水解的最终产物,也是组成各种蛋白质的基本结构单位。在生命现象中起重要作用的蛋白质都是由氨基酸通过肽键(酰胺键)连接而成。蛋白质分子中氨基酸的种类、数量、排列顺序和理化性质的不同,可以形成种类繁多、结构复杂、生物功能各异的蛋白质。
1.氨基酸的结构
氨基酸是羧酸分子中-α-碳原子上的一个氢原子被氨基取代而生成的化合物。
天然蛋白质经酸、碱或酶彻底水解后的最终产物为氨基酸,所以氨基酸是蛋白质的基本结构单位。
自然界中存在的氨基酸约有300多种,但存在于生物体内合成蛋白质的氨基酸只有20种,新近发现的硒代半胱氨酸,被列为第21种氨基酸。不过,目前仅在几种蛋白质中发现含有这种氨基酸。
氨基酸的结构可用下式表示:
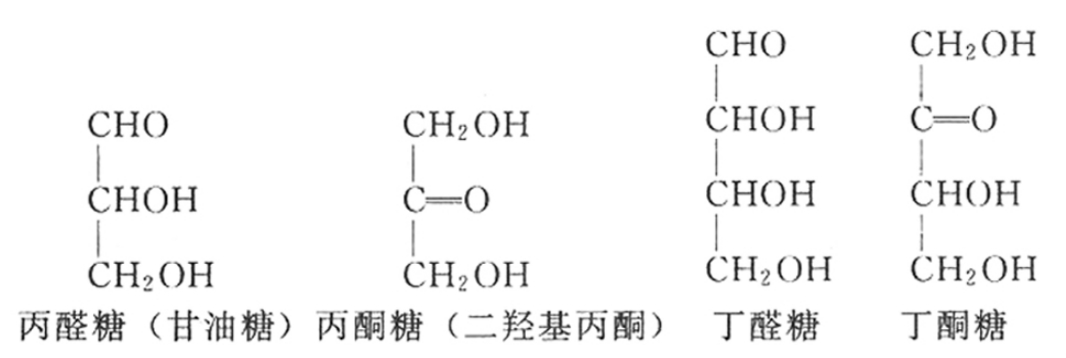
式中,R为氨基酸的侧链基团,方框内的基团为各种氨基酸的共同结构。
各种氨基酸的结构各不相同,但都具有以下特点:
①除脯氨酸外,组成蛋白质的氨基酸都为-α-氨基酸。脯氨酸为-α-亚氨基酸。
②除R基团为H的甘氨酸外,其他各种氨基酸分子中的“碳原子均为手性碳原子,故具有旋光性。氨基酸的构型通常采用D、L标记法。从蛋白质水解得到的-α-氨基酸(除甘氨酸外)都属于L型,即L-α-氨基酸。
③不同的氨基酸因R基团的结构不同而导致其性质不同,各种氨基酸的差异就表现在R侧链上。
在生理pH情况下,氨基酸中的羧基几乎都以-COO-的形式存在,大多数氨基酸的氨基主要以-NH3-的形式存在。
2.氨基酸的分类
对组成蛋白质的20种常见氨基酸的分类方法,主要有3种。
(1)根据酸碱性质分类
①酸性氨基酸 有2种,即谷氨酸和天冬氨酸,它们含有1个氨基和2个羧基。
②碱性氨基酸 有3种,即精氨酸、赖氨酸和组氨酸,它们含有1个羧基、2个以上的氨基或亚氨基。
③中性氨基酸 有15种,是含1个氨基、1个羧基的氨基酸,其中包括两种酸性氨基酸产生的酰胺。
(2)根据R基的化学结构分类
①芳香族氨基酸 有3种,即苯丙氨酸、酪氨酸和色氨酸,它们的R基含有芳香环。
②杂环氨基酸 只有1种,即组氨酸,其R基中含有咪唑基。
③杂环亚氨基酸 只有1种,即脯氨酸,其R基取代了氨基的一个氢而形成一个杂环,从而使脯氨酸中没有自由氨基,而只含有一个亚氨基。
④脂肪族氨基酸 有15种,这与中性氨基酸的15种不完全一致。
(3)根据R基团的极性分类
①极性带正电荷的氨基酸 有3种碱性氨基酸——赖氨酸、组氨酸和精氨酸,在pH=7时带净正电荷。R基团上有氨基,在水溶液中可结合氢离子。
②极性带负电荷的氨基酸 有2种酸性氨基酸——谷氨酸和天冬氨酸,在pH=6~7时,带净负电荷。R基团含有羧基,在水溶液中可释放出氢离子,而分子带负电荷。
③极性不带电氨基酸 R基团为极性基团,但在中性溶液中不解离。如丝氨酸、苏氨酸、酪氨酸、半胱氨酸、天冬氨酸、谷氨酸及甘氨酸等7种氨基酸。甘氨酸的R基团为氢,对强极性的氨基、羧基影响很小,其极性最弱,有时将它归于非极性氨基酸。
④非极性氨基酸 R基团为非极性基团。如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、苯丙氨酸、色氨酸及脯氨酸等8种氨基酸。非极性氨基酸在水中的溶解度比极性氨基酸小。
不同蛋白质中所含氨基酸的种类和数目各异,有些氨基酸在人体内不能合成或合成数量不足,必须由食物蛋白质补充才能维持机体的正常生长发育,这类氨基酸称为营养必需氨基酸,主要有8种。蛋白质含有的营养必需氨基酸数量越多,其营养价值越高。
3.氨基酸的重要理化性质
(1)氨基酸的物理性质 组成蛋白质的氨基酸均为无色晶体,结晶形状因氨基酸的构型而异。熔点极高,一般在200℃以上,加热易放出二氧化碳,而不熔融。“氨基酸大多难溶于有机溶剂,而易溶于强酸、强碱等极性溶剂中,在水中的溶解度也各异,通常酒精能把氨基酸从溶液中析出。
氨基酸的味感随氨基酸不同有所不同,有的无味,有的味甜,有的味苦。谷氨酸的单钠盐有鲜味,是味精的主要成分。天冬氨酸、甘氨酸、丙氨酸、组氨酸、赖氨酸等也都有鲜味,用于食品增添美味。
除甘氨酸外,所有的氨基酸都有不对称碳原子,因此都有旋光性。
(2)两性离解与等电点 无机盐一般为离子化合物,具有高熔点,能溶解于水而不溶于有机溶剂。氨基酸也具有这两个特点,由此可以推断氨基酸也为离子化合物。实验证明,氨基酸在水溶液中或在晶体状态时都以离子形式存在,与无机盐不同的是它以两性离子的形式存在。即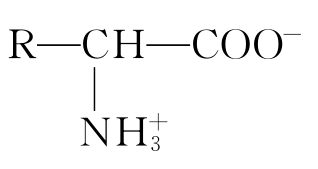 所谓两性离子是指在同一个氨基酸分子上带有能放出质子的-NH3+产正离子和能接受质子的-COO-负离子。因此氨基酸是两性电解质。由于氨基酸中给出质子的酸性基团和接受质子的碱性基团的数目和能力各异,因此它们在水溶液中呈现不同的酸碱性。对于含有1个-COO-和1个-NH3-才的氨基酸而言,当它在水溶液中电离时,由于-NH3-产给出质子的能力大于-COO-接受质子的能力,因此其水溶液呈弱酸性,此时氨基酸主要带负电荷。对于酸性氨基酸而言,它在水溶液中显酸性,氨基酸带负电荷;而对于碱性氨基酸而言,它在水溶液中显碱性,氨基酸带正电荷。因此,氨基酸在水溶液中所带电荷除决定于其本身的结构组成外,还取决于溶液的pH值。
所谓两性离子是指在同一个氨基酸分子上带有能放出质子的-NH3+产正离子和能接受质子的-COO-负离子。因此氨基酸是两性电解质。由于氨基酸中给出质子的酸性基团和接受质子的碱性基团的数目和能力各异,因此它们在水溶液中呈现不同的酸碱性。对于含有1个-COO-和1个-NH3-才的氨基酸而言,当它在水溶液中电离时,由于-NH3-产给出质子的能力大于-COO-接受质子的能力,因此其水溶液呈弱酸性,此时氨基酸主要带负电荷。对于酸性氨基酸而言,它在水溶液中显酸性,氨基酸带负电荷;而对于碱性氨基酸而言,它在水溶液中显碱性,氨基酸带正电荷。因此,氨基酸在水溶液中所带电荷除决定于其本身的结构组成外,还取决于溶液的pH值。
在不同pH值的氨基酸溶液中,氨基酸以阳离子、两性离子和阴离子三种形式存在,它们之间形成一种动态平衡。氨基酸在溶液中的电离可表示如下:
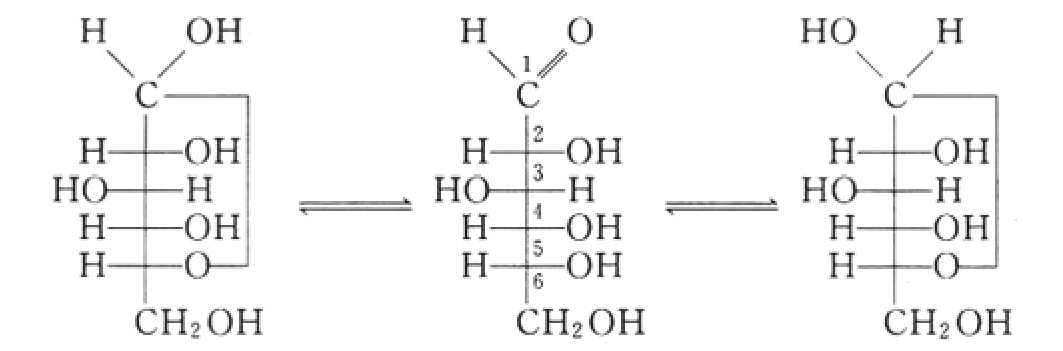
当调节氨基酸溶液的pH,使氨基酸的氨基和羧基的解离度完全相同时,此时[正离子]=[负离子],氨基酸主要以两性离子形式存在,所带的正、负电荷相等,净电荷为零,呈电中性,在电场中既不向阳极也不向阴极移动,即不泳动。这种使氨基酸处于等电状态时溶液的pH值,称为该氨基酸的等电点,用pI表示。
当氨基酸处于等电点时,再加入一定量的酸,此时pH<pI,则Ⅱ中的-COO-接受H+,平衡继续左移,氨基酸主要以I的阳离子形式存在,它在电场中向负极移动。相反,若在已达到平衡的氨基酸溶液中加入适量的碱后,此时pH>pI,Ⅱ中的-NH3+给出H+(与OH-结合生成水),平衡右移,氨基酸主要以Ⅲ的阴离子形式存在,它在电场中向正极移动。
各种氨基酸由于其组成和结构不同,因此具有不同的pI值。pf是氨基酸的一种特征参数,每种氨基酸都有各自的pI。
由于静电作用,在等电点时,氨基酸的溶船度最小,容易沉淀。利用这一性质可用分离制备某些氨基酸。例如生产谷氨酸,就是将微生物发酵液的pH值调到3.22(谷氨酸的等电点),使谷氨酸沉淀析出。利用各种氨基酸的等电点不同,可用通过电泳法、离子交换法等在实验室或工业生成上进行氨基酸的分离和制备。
(3)紫外吸收——芳香族氨基酸具有特征紫外吸收构成蛋白质的氨基酸在可见光区都没有光吸收,但在紫外区苯丙氨酸、酪氨酸和色氨酸具有光吸收能力。苯丙氨酸的最大吸收在259nm,酪氨酸的最大吸收在278nm,色氨酸的最大吸收在279nm。蛋白质由于含有这些芳香族氨基酸,所以也有紫外吸收能力,一般采用紫外分光光度计在280nm波长处测最大光吸收来测定蛋白质的含量。
(4)氨基酸的化学性质
①显色反应 氨基酸与茚三酮的水合物在溶液中共热,经过一系列反应,最终生成蓝紫色的化合物。
但亚氨基酸(脯氨酸和羟脯氨酸)呈黄色。根据-α-氨基酸与茚三酮反应所生成化合物的颜色深浅程度以及释放出CO2的体积,也可定量测定氨基酸。
具有特殊R基团的氨基酸,可以与某些试剂产生独特的颜色反应,如蛋白黄反应、米伦反应(Millon反应)和乙醛酸反应等(见表2—1)。这些颜色反应可作为氨基酸、多肽和蛋白质的定性和定量分析的基础。
②与甲醛反应 氨基酸在溶液中有如下平衡:
表2—1 鉴别具有特殊R基团氨基酸的颜色反应

氨基酸在溶液中主要以两性离子存在,故不能用酸或碱滴定测其含量,但如用甲醛处理氨基酸时,反应生成一羟甲基氨基酸和二羟甲基氨基酸,使上述平衡向右移动,一促使氨基酸分子上的-NH3+解离释放出H+,从而使溶液酸性增加,就可以酚酞作指示剂,用NaOH来滴定。反应过程如下:
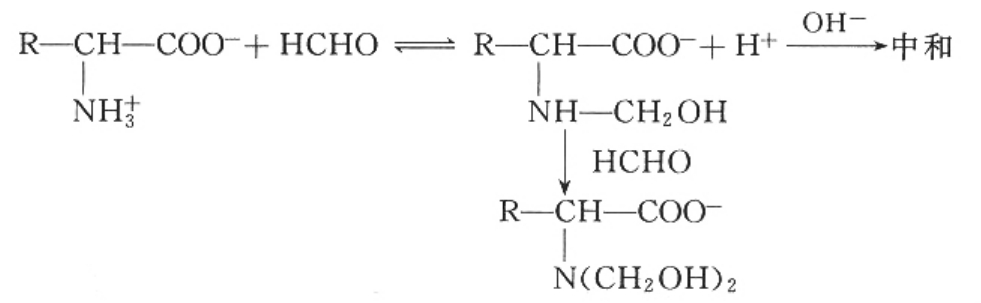
由滴定所用的NaOH量就可以计算出氨基酸中氨基的含量,也即氨基酸的含量。这就是氨基酸的甲醛滴定法。此法也可用予测定蛋白质水解或合成的程度,虽精确度稍差,但仪器设备简单,操作简便,故亦被广泛应用。
③与亚硝酸反应 氨基酸,除亚氨基酸(脯氨酸、羟脯氨酸)的亚氨基,精氨酸、组氨酸和色氨酸环中的N以外,-α-氨基均可与亚硝酸作用产生羟基酸并放出氮气(N2)。
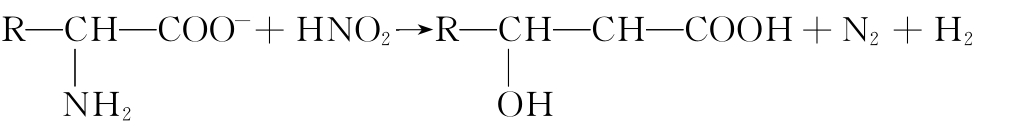
反应放出的N2量的一半来自氨基酸分子的氨基,故可用气体分析仪来加以测定。这是范氏定氮法的原理。范氏定氮法常用于氨基酸定量及蛋白质水解程度的测定。
④脱羧反应 氨基酸经氨基酸脱羧酶催化脱羧,生成伯胺并相应放出CO2气体。脱羧酶专一性很强,一种氨基酸脱羧酶只能催化一种氨基酸脱羧。例如,大肠杆菌L-谷氨酸脱羧酶,只催化L-谷氨酸脱羧:
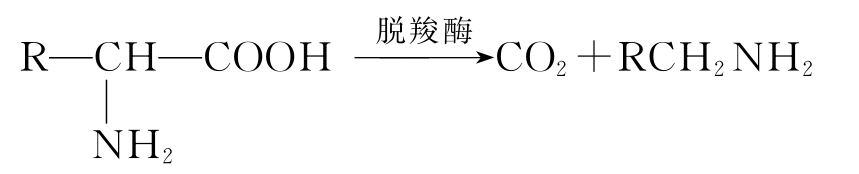
反应生成的CO2可用瓦氏呼吸计定量测定。释放CO2的物质的量等于溶液中氨基酸物质的量。目前氨基酸发酵生产中普遍用此方法进行生产检验。
4.氨基酸的制备
由于科学实验、医药卫生和食品工业生产各方面对氨基酸的需求日益增多,因此氨基酸的合成就显得十分必要。制备氨基酸的方法主要有以下几种:
(1)水解蛋白法 水解蛋白法是蛋白质经酸、碱或多种蛋白酶水解生成氨基酸,再用适当的方法加以分离、提纯得到拟制取的某些氨基酸。此法又可分为酸水解、碱水解和酶水解等。
酸水解是将蛋白质与相当蛋白质体积10~15倍的25%H2SO4或30%HCl,在110℃~115℃长时间煮沸,所得的产物是氨基酸混合物,经NaOH中和过滤,再将pH值调节到所要制备的氨基酸的等电点,该氨基酸即可沉淀析出。酸水解的优点是水解彻底,氨基酸都是L-氨基酸。色氨酸及部分羟基氨基酸受到破坏,同时使某些氨基酸失去旋光性。
碱水解是将蛋白质用6mol/L NaOH煮沸数小时,即可完全水解得到氨基酸混合物。此法的优点是不破坏色氨酸,但是胱氨酸、半胱氨酸及精氨酸等大部分被破坏。
酶水解是比较理想的方法。酶水解所需条件温和,不会破坏氨基酸,也不会使氨基酸失去旋光性,但此法水解不彻底,中间产物较多。
(2)人工合成法 用有机合成方法制备氨基酸的缺点是所得的氨基酸都是外消旋产物,故只适用于用其他方法难以制备的少数氨基酸,如苏氨酸、色氨酸和蛋氨酸等。
(3)微生物发酵法 用微生物发酵制备氨基酸始于20世纪60年代,现在味精厂多采用发酵法生成谷氨酸。微生物发酵法是生产氨基酸的一条非常有前景的途径。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















