(一)血小板计数
参见《临床检验基础》
(二)血块收缩试验
【原理】血块收缩试验(clot retractiontest,CRT)主要用血浆法。在富含血小板血浆中,加入Ca2+或凝血酶,促进血浆凝固,血小板收缩蛋白使血小板伸出伪足收缩,纤维蛋白网收缩,血清析出。测定析出血清的多少,反映血小板血块收缩的能力。
【器材】离心机、水浴箱、刻度小试管、刻度吸管、无菌注射器等。
【试剂】
1. 0.05mol/L氯化钙溶液或20U/ml凝血酶溶液。
2. 0.109mol/L枸橼酸钠溶液。
【操作】
1.静脉采血,用0.109mol/L枸橼酸钠溶液按血液与抗凝剂9:1抗凝,转速1000r/min,离心10min,分离富含血小板血浆(PRP),剩余血液以转速30000r/min,离心20min,分离贫血小板血浆(PPP)。
2.用PPP调整PRP中血小板数为200.0×109/L。
3.取PRP 0.6ml加入有刻度的小试管中,置37℃水浴3min后,再加入0.05mol/L氯化钙溶液或20U/ml凝血酶溶液0.2ml。混匀后,于37℃水浴2h,用竹签挑取血浆凝块,准确测量血清的体积(ml)。
4.计算
![]()
【注意事项】
1.温度须控制在37℃。
2.测定标本必须进行血小板数的调整。
【参考范围】血块收缩率>40%
【临床意义】
1.减低 见于血小板减少或功能异常,如ITP、原发性血小板增多症、血小板无力症、低(无) 纤维蛋白原血症等。
2.增高 见于纤维蛋白原增高和先天性因子Ⅻ缺乏症等。
(三)血小板黏附试验
【原理】血小板黏附试验(platelet adhension test,PadT)使用玻璃滤器法。血小板具有黏附异物表面的特性,一定量血液通过玻璃滤器,一定数量的血小板就黏附在玻璃上,故经过玻璃滤器后的血小板数减低,通过比较经过玻璃滤器前后的血小板之差,计算出血小板黏附百分率。
【器材】玻璃滤器、硅化或塑料注射器和试管。
【试剂】EDTA-Na2抗凝剂。
【操作】
1.静脉采血1.5ml。
2.立即将血滴入玻璃滤器漏斗内。
3.将最初滤过的4滴血液收集在含有0.5mgEDTA-Na2抗凝剂的试管中,立即混匀做血小板计数。
4.把注射器余下的血液加4滴于含有0.5mgEDTA-Na2抗凝剂的试管中,混匀做血小板计数,计数值为滤过前血小板数。
5.计算
![]()
【注意事项】
1.顺利采血,避免产生气泡、溶血和凝血。采血的静脉不宜太粗以便控制血流速度。
2.检测前1周,禁服阿司匹林类药物。
【参考范围】(31.9±10.9)%。
【临床意义】
1.血小板黏附率减低 见于vWD、巨大血小板综合征、血小板无力症、肝硬化、尿毒症、服用血小板抑制药物等。
2.血小板黏附率增高 见于高凝状态和血栓性疾病,以及糖尿病、肾小球肾炎、口服避孕药、妊娠高血压疾病等。
(四)血小板聚集试验
【原理】血小板聚集试验(platelet aggregation test,PAgT)应用比浊法。在血小板聚集仪特定的连续搅拌条件下,在富血小板血浆中加入各种诱导剂。血小板发生聚集,PRP悬液浊度随之下降,光电池将光浊度的变化转换为电讯号,记录在记录纸上。根据描记曲线计算出血小板聚集的程度和速度,判断血小板聚集能力。
【器材】
1.血小板聚集仪和记录仪。
2.其他:血细胞计数板、显微镜、离心机及试管等。
【试剂】
1. 0.109mol/L枸橼酸钠溶液。
2.血小板聚集诱导剂:可选用下列任意一种:ADP、ATP、肾上腺素、胶原、瑞斯托霉素、花生四烯酸,常用为ADP诱导剂。
【操作】
1.静脉采血4.5ml,加0.109mol/L枸橼酸钠溶液0.5ml抗凝,分离富血小板血浆(PRP),和贫血小板血浆(PPP)。以PPP调整PRP血小板数至250×109/L。
2.按说明书操作血小板聚集仪
(1)接通聚集仪电源预热。
(2)接通记录仪电源。
(3)将被检者PPP和调整后的PRP各0.3ml分别加入到2只比色杯中,置于聚集仪上的温浴槽,温浴3min。
(4)将 PPP置于测定槽,调零。
(5)将调整后的PRP置于上述同一测定槽,加入搅拌珠,调至PRP吸光度为100%。
(6)搅拌10~20min,将1/10体积的诱导剂加入PRP中,启动反应按钮。
(7)记录仪记录5min反应过程的变化特点。
【注意事项】
1.样本采集:要求空腹采血,试验前1周禁服阿司匹林等抑制血小板聚集的药物。
2.按照离心条件制备PRP,离心力过高会使血小板下沉,尤其是体积大的血小板,后者的聚集反应性往往较强。另外避免红细胞混入、溶血等现象。
3. PRP制备30min内不能进行测定,此时的血小板聚集反应性差。
4.标本采集后应放置在15~25℃,3h内完成检测。
5.如需进行多种诱聚剂测定,应优先进行花生四烯酸和瑞斯托霉素聚集试验。
【参考范围】不同仪器、不同聚集剂的浓度和剂量,有不同的参考值。以MG-196型血小板聚集仪为例,其参考值和参数分析见表16-4。
表16-4 血小板聚集试验的参考值

【临床意义】
1.增高 见于血栓前状态和血栓心性疾病、高β-脂蛋白血症、糖尿病等。
2.减低 见于血小板无力症、巨大血小板综合征、血小板贮存池病、肝硬化、尿毒症等。
(五)血小板相关抗体检测
【原理】血小板相关抗体检测(platelet associated antibody,PAIg)使用双抗夹心ELISA法。以PAIgG为例,将抗人IgG抗体包被在酶标反应板孔内,加入待检血小板溶液中的IgG与之结合,再加入酶标记的抗人IgG抗体,形成抗人IgG抗体-PAIgG-酶标抗人IgG抗体复合物,洗涤后加入底物显色,颜色深浅与血小板PAIgG含量成正比,根据测得的吸光度值A,从标准曲线中计算血小板溶液中PAIgG的含量。
【操作】
1.血小板溶解液制备:静脉血4.5ml加5%EDTA-Na20.5ml抗凝,以1000r/min离心8min,取上层PRP,PRP再以3000r/min离心20min,弃去上清液,留取血小板;用血小板洗涤液洗涤3次,用缓冲液调整血小板浓度为100×109/L。用11%TritonX-100按1:10(V/V)加入血小板悬液中(终浓度为1%)使血小板溶解,置于4℃30min后,转速3000r/min,离10min,取上清液测定。
2.按照试剂盒说明和要求操作:包被、加样、酶标抗体、显色、终止、制作标准曲线,参见vWF检测。
3.酶标仪于492nm处测吸光度(A值),从标准曲线中可查出被检样本吸光度所对应浓度,结果以ng/107血小板表示。
【注意事项】
1.分离血小板尽可能地避免红细胞和白细胞的掺入。
2.血小板溶解液可贮存在 -20℃,1周内测定。
3.注射器和试管必须涂硅或用一次性塑料制品,以减少血小板激活。
4.标准曲线及待测标本均做两孔,取平均值。如两孔A值相差>0.1,均应重测。
5.试验前2周停用皮质激素。
【参考范围】 PAIgG:0~78.8ng/107血小板,
PAIgM:0~7.0ng/107血小板,
PAIgA:0~2.0ng/107血小板,
PAC3:0~18.0ng/107血小板。
【临床意义】作为ITP诊断指标之一。90%以上ITP患者的PAIgG增高,如果患者PAIgM、PAIgA和PAC3也同时阳性可以确诊ITP。ITP患者经激素治疗有效,则PAIgG水平下降。如PAIgG在2周之内下降者其预后较好。但血小板相关抗体阳性,也可见于SLE、慢性活动性肝炎、淋巴瘤、多发性骨髓瘤、Evans综合征等。
(六)血小板第3因子有效性检测
【原理】血小板第3因子有效性检测(platelet factor 3 availability test,PF3aT)是将正常人、患者富血小板血浆(PRP)和贫血小板血浆(PPP)交叉配合,以白陶土作为血小板激活剂,血小板活化后,膜内的磷脂酰丝氨酸转向膜外,形成PF3,参与血浆凝固。再测定各组血浆凝固时间,比较各组凝固时间长短,从而得知PF3是否有缺陷。
【试剂】
1.0.109mol/L枸橼酸钠溶液。
2.0.025mol/L氯化钙溶液。
3.40g/L白陶土悬液:取白陶土4g,加入100ml生理盐水中。
4.血小板稀释液:同血小板计数。
【操作】
1.患者和正常对照分别静脉采血2.7ml,置于塑料试管,0.109mol/L枸橼酸钠0.3ml抗凝,制备富血小板血浆(PRP) 和贫血小板血浆(PPP)血浆。
2.分别计数患者与正常对照者的PRP血小板数,并用自身的PPP调整血小板数到250×109/ L,PPP的血小板要求调整到20×109/L以下。
3.取8支小试管分为4组,每组2支,按表16-5操作。
4.将上述8支试管置37℃水浴2min,从第1支起依次每隔2min加入白陶土悬液0.2ml。记录加入白陶土的时间,其间摇动数次。
表16-5 PF3aT的测定操作程序
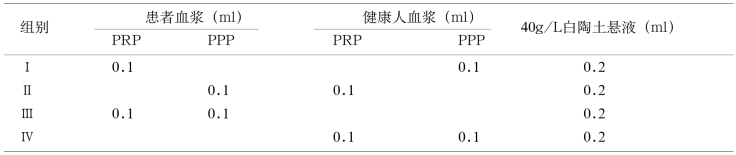
5.20min后各管依次加入0.2ml氯化钙溶液,同时立即开动秒表,将试管浸入37℃水浴中,不断轻轻摇动,约30s时取出试管观察,准确记录凝固时间。
【注意事项】
1.患者和正常对照同时采血,并必须顺利,避免溶血和凝块。
2.注意血液与抗凝剂的比例,对严重贫血或血细胞比容明显增高的血液应调整抗凝剂的用量,调整公式为:抗凝剂(ml)=(100-Hct)×血液(ml)×0.00185。
3.血小板悬液避免混入红细胞。
【参考范围】第1组比第2组的结果延长超过5s,则为PF3aT有效性减低。
第3组与第4组为对照,如果血友病时第3组也会延长。
【临床意义】PF3aT减低:见于先天性血小板第3因子缺乏症、血小板无力症、巨大血小板综合征、血小板减少症、DIC及肝硬化等。
(七)血小板膜糖蛋白检测
【原理】用流式细胞术检测。将抗人血小板糖蛋白抗体与血小板膜糖蛋白结合,再加入标有荧光的鼠抗人血小板糖蛋白单克隆抗体,形成复合物,流式细胞仪检测。血小板表面糖蛋白含量与检测荧光强度成正比。
【临床意义】GPⅡb/Ⅲa缺乏见于血小板无力症。GPIb、GPV、GPⅨ数量减少或缺陷,见于巨大血小板综合征。
(八)β-血小板球蛋白检测
【原理】用双抗体夹心ELISA法。选抗β-TG包被酶标反应板,与待检血浆中β-TG抗原特异性结合,再加入酶标抗β-TG抗体,加入底物与酶反应显色,其显色与待检血浆β-TG抗原量成正比。
【操作】
1.标本制备:取5%EDTA-0.27%茶碱抗凝剂0.28ml于塑料试管中。用8号针头采血5ml,弃去最初的2ml后,自然滴血约2.5ml于抗凝剂的试管(以血液与抗凝剂V/V9:1抗凝)。轻轻混合即刻置于冰水浴,4℃转速3500r/min,离心30min,吸取上层血浆置于低温冰箱。
2.包被、加样、酶标抗体、显色、终止、制作标准曲线,参见vWF检测。
3.计算:酶标仪上492nm比色,测定吸光度A,然后从标准曲线上读出样品测定的数值。
【注意事项】使用适当的含血小板抑制剂的抗凝剂,防止血小板发生体外活化而释放β-血小板球蛋白,引起结果偏高。
【参考范围】血浆β-TG:6.6~26.2μg/L。
【临床意义】增高:见于血栓前状态和血栓性疾病,反映血小板被激活及其释放。先天性或获得性贮存池病,血小板大量被破坏或消耗。β-TG主要经肾排泄,尿毒症等肾功能障碍时,β-TG明显升高。
(九)P-选择素检测
【原理】用免疫荧光法。以异硫氰酸荧光素(FITC)标记的抗P-选择素抗体,与血小板膜表面P-选择素特异性结合,结合在血小板膜上的异硫氰酸荧光素的量与血小板膜表面P-选择素呈正相关,通过检测荧光强度,计算待检测血小板膜表面P-选择素的含量。
【器材】血细胞计数板、显微镜、荧光分光光度计。
【试剂】
1.抗凝剂:5%EDTA-Na2抗凝剂。
2.4%多聚甲醛。
3.血小板洗涤液。
4.抗血小板膜表面P-选择素单克隆抗体试剂盒。
【操作】
1.标本采集:0.2ml5%EDTA-Na2置于硅化管中,患者空腹静脉采血1.8ml,轻轻混合,转速1000r/min,离心10min,分离PRP后立即与4%多聚甲醛等体积混合后置于室温30min。
2.用血小板洗涤液洗涤上述悬液3次。再用洗涤液调整血小板浓度为1.0×109/L。
3.取血小板悬液lml,加入抗血小板膜表面P-选择素单克隆抗体(使悬液浓度65μg/ ml),混匀后置于室温30min,再用洗涤液洗涤2次,加2ml洗涤液悬浮血小板。
4.在上述血小板悬液中加10μl FITC标记的羊抗鼠IgG抗体,避光置于室温下20min,用洗涤液洗涤2次,重新悬浮于0.01mol/LPBS中,调整血小板浓度为250×109/L。
5.用0.01mol/LPBS配制标准异硫氰酸荧光素溶液。
6.非特异性结合对照管:未加抗血小板膜表面P-选择素单克隆抗体管作为非特异性结合对照管。
7.用荧光分光光度计测定荧光强度
8.计算

(公式中:IgG相对分子质量为165000,其摩尔浓度在1M的分子数为6.023×1023。当FITC与抗体分子以1:1结合时,根据B值换算血小板表面P-选择素分子数)。
【注意事项】
1.血小板计数必须准确。血小板洗涤过程避免产生气泡而激活血小板。
2.操作过程的环境温度为25℃适宜。
【参考范围】(7900~10100)分子数/血小板。
【临床意义】血小板表面P-选择素分子数表达增强表明血小板激活,是血小板活化的特异分子标志物之一。增高见于血栓性疾病、DIC以及糖尿病、妊娠高血压疾病和恶性肿瘤等。
(十)血浆血栓烷B2(TXB2)检测
【原理】用[125I]-标记测定法。将TXB2和络氨酸甲酯(TME)反应结合形成TME-TXB2,然后用[125I]进行标记,形成[125I]-TME-TXB2示踪剂。待检样品中TXB2和成品125I-TMETXB2与限量抗体共同竞争结合,从校正曲线上查出待检样品中TXB2的浓度。
【器材】自动γ免疫计数器。
【试剂】
1.示踪剂[125I]-TME-TXB2工作液,临用前以PBS稀释至100μl约1000cpm。
2.抗血清:用前稀释至100μ1,结合[125I]-TME-TXB21000cpm35%~40%为工作滴度。
3.分离剂:取100~120目的药用炭2g,右旋糖酐-70 0.4g于100mlPBS中,磁力搅拌20min。
4.标准TXB2工作液。
【操作】
1.血浆制备:塑料空针内预先加入吲哚美辛-肝素液0.1ml,静脉采血3ml,混匀,4℃转速3500r/min,离心20min,分离血浆,-20℃以下保存。
2.取10mm×100mm塑料管,总计数管(T)加PBS0.7ml,非特异结合管(NSB)加PBS 0.2ml,零标准管(S0)加PBS0.1ml,校正曲线管(S1~7)加入不同浓度的标准液。
3.每管各加[125I]-TME-TXB2工作液0.1ml。除T和NSB管外,其余加抗血清0.1ml;混匀放2~4℃,12~16h。
4.除T管外,各加分离剂0.5ml,充分混合,放2~4℃ 20min。离心,转速3500r/min(4℃)15min。将上清液全部倾入另一管中,在自动γ免疫计数器上测放射性。
5.以B/B0%为纵坐标,标准管TXB2浓度为横坐标,在半对数纸上制校正曲线。依样品管的B/B0值从校正曲线上查出TXB2浓度,再换算成ng/L。
【参考范围】男性(130±38)ng/L,女性(136±5l)ng/L。
【注意事项】
1.[125I]-TME-TXB2保存在无水乙醇中,6个月后仍有较高免疫活性。
2.血浆中的蛋白质和脂肪酸对测定有明显干扰,故样品必须提取和纯化。
【临床意义】TXB2增高见于血栓前状态和血栓病、糖尿病等。减低见于服用阿司匹林等非甾体类抗炎药物,或先天性血小板环氧化酶缺陷。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















