组织培养技术发展至今,从培养对象来说,人体内的组织和细胞几乎无一不能培养。但由于细胞分化所导致的组织和细胞相互差异,各种组织细胞均有着不同的生物学个性,这反映在对体外培养条件上各有不同的要求,但是细胞培养也存在着共性和共同的需求条件,其基本原则是保证无微生物污染和不受其他有毒有害因素的影响。组织细胞培养的具体工作有器皿清洁、试剂和培养液的配制,分离培养细胞、细胞传代、细胞的冻存、复苏与运输等。以上过程均需坚持无菌原则。本章着重介绍组织细胞培养的基本要求和操作要领,只要熟悉了这些基本内容,并以其为基础,其他不难掌握。
一、基本要求
(一)无菌操作
由于体外培养细胞缺乏抗感染能力,故操作时应做到严格无菌。无菌是决定培养成败的关键。
(二)培养前的准备
培养前的准备工作必须做好,尤其对于初学者,应制订分门别类的操作卡片,各卡片记录所需的器材和物品名称、要求和数量等,这样有利于统一消毒,避免因操作开始后,因物品不全在往返拿取时增加污染机会。
1.操作台消毒 多用紫外线灯灭菌,效果好,用30W紫外灯,操作室根据面积大小消毒30~50min。净化工作台亦需设紫外线灯,主要用于消毒台面和台面上的用品,但对台面流动的空气无意义。紫外线灯只有直接杀菌的作用,工作野用品过多或重叠放置,物品相互遮挡射线,会降低消毒效果。
2.洗手和着装 原则上和外科手术相同。在利用无菌箱工作时,因整个前臂要伸入箱内,洗刷时一定要清洗到肘部。一般用75%的乙醇擦洗消毒较方便,必要时亦可用0.2%苯扎溴铵洗涤消毒。在净化工作台操作时,需戴口罩和工作帽,着一般工作服,但无菌室内工作需着消毒衣帽。
3.火焰消毒 无菌环境中进行培养或其他无菌操作时,首先要点燃用不含杂质的95%乙醇的酒精灯。之后的一切操作,如开启和封闭瓶口等,都需经过火焰烧灼。但是,需注意的是金属器械不能在火焰中烧过长时间,且烧过的金属器械要待冷却后才能夹取组织,以免损伤组织。已吸取过培养液的吸管烧后不能再用,残留的培养液被烧焦后形成碳膜,如再用会将有害物质带入培养液。
(三)培养操作
进行培养操作时,要严格无菌操作,动作要准确敏捷,不能用手触及已消毒的器皿,如已接触,要用火焰烧灼消毒触及部或更换。工作台上的东西应摆放合理,工作要有一定的顺序性,培养瓶在开瓶以后,应保持45°或平放,开口向上可增加落菌机会。吸取不同培养用液时应分别使用吸管,工作中不能面向操作野讲话或咳嗽,以免增加污染机会。
(四)实验室设计
实验室应分为无菌室、准备室和洗刷消毒室。无菌室包括操作间和缓冲间。缓冲间能保护无菌间的无菌环境,可兼有更换无菌衣帽和进行一些简单操作(如离心等)的功能。经常消毒是保持无菌状态所必需的,通常在使用前紫外线照射(1~2h),每周甲醛、乳酸或过氧乙酸熏蒸(2h)和每个月本扎溴铵擦拭地面和墙壁一次的方式进行消毒。使用无菌室时应按以下程序:①紫外线无菌室消毒,准备实验材料和器具;②手部消毒,穿戴无菌衣帽和口罩;③关闭杀菌灯,通过一定路线拿入必要物品;④手部再次消毒后,进行实验;⑤完成实验,将用完物品移出室外。
无菌室中一般在超净工作台上进行细胞培养,外界空气通过过滤器从上面、侧面或正面流入操作箱内,形成气流屏障,以保持台面无菌。工作程序为:①接通电源,开紫外线灯进行消毒15~30min;②打开操作窗,消毒手部后进行操作;③操作完毕后清理超净台面,关闭操作窗,切断电源。
二、基本操作技术
(一)器皿清洗
除了一些一次性无菌实验用品可用后即弃,其他的器材需要清洗后消毒灭菌,再重复使用。见本篇第25章第一节。
(二)消毒和灭菌
污染是导致细胞培养失败的主要原因,通过消毒灭菌和无菌操作技术可以防止培养物污染。具体方法见本篇第25章第二节。
(三)取材
理论上,幼体个体组织比年老个体组织易于培养,分化程度低的组织比分化程度高的组织容易生长,肿瘤组织比正常组织容易培养。在无特殊要求时,取易于培养的组织进行培养,成功率高。取材之后立即培养最好,如不能立即培养,应把组织切成1cm× 1cm的小块,置于培养液中,4℃保存,存放时间不宜超过24h,从体内取材的组织,应严格保持无菌。为减少污染,可能污染的组织培养前,可用含青霉素、链霉素的BSS液,漂洗数次后再培养。
(四)分离
从体内取出的组织均由众多结合紧密的细胞和纤维成分组成,体积大于1mm3的组织块置于培养瓶后,组织块中心的细胞因为营养有限而代谢不良。为获得多量的生长良好的细胞,必须把组织细胞分散开,能达到单细胞水平更好,分散细胞的方法分机械法和化学法。根据组织种类和培养要求,宜采用不同方法。
1.离心分离法 如培养物为细胞悬液,如血液、羊水、腹水、胸腔积液等时,可采用离心分离法,一般用低速离心每分钟500~1 000转,离心5~10min即可。如悬液量大,离心时间可适当延长,但也不可速度过大和时间过长,以免造成易压挤导致细胞死亡。
2.机械分散法 主要用剪切法。一般将组织剪切成1mm3大小,再加Hanks液后,用吸管反复吸吹冲打,低速离心,去上清,余下组织进行培养。某些软组织,如脑、胚胎等,可将组织放入注射器压挤法或将组织置于不锈钢网中压取法。机械法较简单易行,但对组织可能有一定损伤,较适用于软组织。
3.消化分离法 是在把组织剪切成较小的体积的基础上,应用生化和化学的手段进一步分散组织,这种方法较为常用,最后被处理的组织分散成细胞团或单个细胞,加入培养液制成细胞悬液,接种入培养皿中后容易生长和繁殖。根据组织不同,消化手段也不同。
(1)胰蛋白酶消化法:应用较广,胰酶主要包括胰蛋白酶、胰淀粉酶和胰脂肪酶。胰蛋白酶消化细胞间质较少的软组织,如胚胎组织、羊膜、上皮组织、肝、肾等软组织,对传代细胞也非常好。胰蛋白酶的消化作用,与pH、温度、组织大小、组织硬度及胰蛋白酶的浓度都有关系。胰蛋白酶的浓度在0.01%~0.5%范围,常用0.25%浓度,37℃温度,消化5mm3大小的胚胎类软组织,20~30min即可。组织块大或成体较硬组织,可延长至数小时。当置于4℃时,仍有缓慢消化作用,消化时间可延长12~20h。浓度过大或消化时间过长,细胞可被消化掉;但消化不充分也达不到分散细胞的目的。pH 8~9较好。因此,在新条件下使用胰蛋白酶时,可做些探试,以确定最佳参数。其程序为:①剪切。把组织剪切成3mm×3mm×3mm的小块。②加液。把组织置于比其量多30~50倍的0.25%胰蛋白酶中(预加温至37℃)。③消化。37℃温箱中消化30~60min,每隔5~10min摇动一次或者置电磁搅拌器台上消化。④消化完毕,倒入离心管中,每分钟800转离心6~8min后吸除上清液。⑤用Hanks液漂洗2~3min,离心去上清,共两次。⑥每分钟800转离心5min后去上清,加入一定量的营养液,通过100μm孔径的筛网过滤,收集细胞悬液,用吸管吸取1滴细胞悬液滴于载物片上观察,如细胞分散、形态完整,可用于培养。
(2)胶原酶消化法:胶原酶是一种从细菌中提取的酶,对胶原有很强的消化作用。胶原酶对细胞间质有较好的消化作用,而上皮细胞对其的耐受性好,所以胶原酶能使上皮细胞和胶原脱离而不受伤害,效果好。常用剂量为最终浓度200U/ml或0.1~0.3μg/ml。此酶消化作用缓和,且无须机械振荡,消化过程为:①漂洗干净的组织剪成1~5mm3的小块,移入青霉素小瓶中;②加入适量0.2%胶原酶溶液;③置36.5℃中4~48h,如消化缓慢可延长至3~5d,期间不必摇动;④如见组织已经变软,散于瓶底,振荡后可散成细胞团和单个细胞;⑤低速离心培养液5min,去上清,重悬于BSS中,再低速离心5min,去上清;⑥加入新培养液制备成细胞悬液,可接种进行培养。另外,胰蛋白酶和胶原酶可以协同应用,浓度为每毫升含胰蛋白酶0.1mg、胶原酶0.25mg。两酶的差别见表26-1。
表26-1 胰蛋白酶和胶原酶生物活性的差别
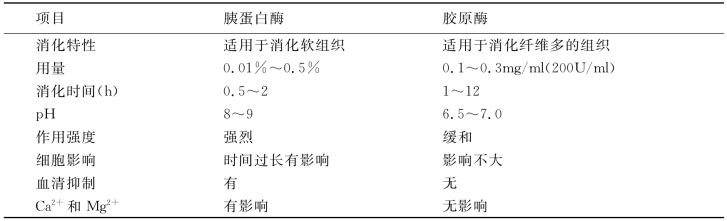
除胰蛋白酶和胶原酶外,其他有消化作用的酶还很多,如链霉蛋白酶、透明质酸酶、黏蛋白酶等,需根据不同需求选用。
(3)EDTA消化法:EDTA(二乙烯四乙酸二钠)是一种非酶性消化物,常用不含Ca2+和Mg2+的BSS配成0.02%的工作液。关于EDTA的作用机制,一些学者有这样的观点。一些组织,尤其是上皮组织,在生存中需要Ca2+和Mg2+才能维持组织的完整性。EDTA能从这些组织生存环境中吸收这些离子,形成螯合物,能促进细胞相互分离。EDTA作用比胰蛋白酶缓和,很少用于单独消化新鲜组织(传代细胞可单用),如与胰蛋白酶按不同比例相混合并用,消化作用更好。EDTA最适消化传代细胞,也多与胰蛋白酶混合使用(1∶1或2∶1)。用EDTA和胰蛋白酶混合消化法传代的过程如下:①吸出培养液,注入EDTA(0.02%)和胰蛋白酶(0.25%)混合液(1∶1),置37℃或室温中作用3~5min。在镜下监视细胞状态,当见到细胞质回缩,胞体趋于变圆,细胞相互之间缝隙变大,立即终止消化。②吸出消化液,注入适量Hanks液轻轻洗1或2次,不要用力过猛,以免把附着不牢的细胞冲掉。③吸出Hanks液,加入适量培养液后,用吸管吸、吹培养液,反复轻轻吹打瓶壁上的细胞,使之脱落入培养液中形成细胞悬液。
(雷 霞)
参 考 文 献
[1]章静波.细胞生物学使用方法与技术.北京:高等教育出版社,1990:1-50
[2]Ham R G,McKcehan W L.Media and growth requirements.Methods Enzymol,1979,58:44-93
[3]王捷.动物细胞培养技术与应用.北京:化学工业出版社,2004:2-60
[4]R.I.费雷谢尼.动物细胞培养-基本技术指南.章静波,徐存栓,译.第4版.北京:科学出版社,2004:1-85
[5]司徒镇强,吴军正.细胞培养.西安:世界图书出版社,1996:1-21
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















