一、角膜基质重建
基质是角膜重建过程中维持透明和机械强度的关键所在。人们可以利用人工合成材料或天然材料构建角膜基质。
(一)聚乳酸与聚羟基乙酸的共聚物(PLGA)作为构建角膜基质
将培养的角膜基质细胞接种到PLGA材料上,构建成角膜基质细胞-PLGA复合物(图14-12,彩图50)。扫描电镜检查发现,角膜基质细胞能与PLGA牢固地结合(图14-13),并能在PLGA上增殖,材料对细胞没有毒性。
(二)应用胶原重建角膜基质
图14-12 角膜基质细胞-PLGA复合物

图14-13 角膜基质细胞与PLGA牢固结合
混匀角膜基质细胞和牛的Ⅰ型胶原,调节pH值到7.4,倒入带有锚环的有盖培养皿中,37℃培养1h使之凝胶化,基质也可选用人的Ⅰ型和Ⅲ型胶原,锚定环被设定用来防止游离凝胶收缩。在培养过程中锚定环可以维持表面积稳定;收缩现象只在轴向发生。锚定环限定于重建组织的边缘,不会干扰细胞,而且使得后继的处理和气液界面培养更加方便。这种方法生产的凝胶中散布有成纤维细胞,培养过程中,成纤维细胞重建细胞外基质,为上皮细胞提供更好的基底。
(三)应用胶原-硫酸软骨素重建角膜基质
1.缓冲液为0.5mol/L NaOH,2.2g/L NaHCO3和47.7g/L HEPES混匀。
2.在0.4ml的13.5g/LⅠ型胶原溶液和0.05mol的1g/L硫酸软骨素溶液中,加入的10×DMEM和0.05ml的1×106/ml角膜基质细胞液 ,置冰盒内缓慢搅拌混匀 ,再加入0.05ml缓冲液及0.02%戊二醛交联液0.05ml,置37℃下约30min,加甘氨酸中和,可重建成直径为1cm,厚度为1mm的纤维板层结构,加入2ml的DMEM培养液(含15%胎牛血清)。
上述构建的角膜基质在机械强度和超微结构上与正常角膜基质相去甚远,用于动物实验的可能性很小,但是可以进行体外的研究。笔者从1994年开始进行异种角膜基质免疫原性和移植后角膜神经的恢复、植床的组织学变化、移植后不同时期角膜透明度、屈光度和厚度变化等方面进行了研究,结果发现:异种角膜基质的免疫原性很低,可以用于异种移植,移植后角膜基质的厚度、屈光度保持不变,自体神经可以长入,角膜知觉大部分恢复,上皮细胞贴附牢固,细胞间和细胞基底膜间生理连接正常,培养的角膜上皮细胞在气液界面可以在异种角膜基质上形成复层。角膜基质是良好的基底膜含有角膜细胞生长所必需的Ⅳ型胶原、层粘连蛋白和纤维连接蛋白等细胞外基质成分,具有抑制角膜新生血管的作用,免疫原性低和诱导培养上皮细胞分化和确定极向的作用。因此可以认为异种角膜基质具有成为培养细胞载体,用于合成人工生物角膜的潜能。另外,合成、改性和筛选高分子合成材料制作角膜基质也是目前重要的研究方向。
二、角膜上皮重建
目前上皮重建有多种方法可选,体外扩增后接种于重建的基质上,培养基换为上皮培养基,包含上皮生长所需的各种成分,在这种条件下,上皮细胞可以整齐地黏附于基质上,然后应用气-液界面培养,促进上皮形成复层。应用灌注培养器(图14-14,彩图51;图14-15,彩图52)或旋转培养箱产生的气液界面更加接近于体内微环境。以胶原凝胶、软性角膜接触镜及羊膜为载体构建成上皮植

图14-14 曲面灌注培养器

图14-15 基本灌注培养器
片的研究均有报道,羊膜被认为是工程化角膜上皮的最佳载体。目前,应用羊膜为载体扩增角膜缘干细胞,构建工程化角膜上皮层治疗眼表疾病已成为研究的热点。但羊膜作为基底膜如何维持角膜缘干细胞的特性(图14-16,彩图53)、促进上皮细胞迁移、黏附、分化及基底膜成分与黏附分子相互作用机制还不明确,需要进一步研究探讨。
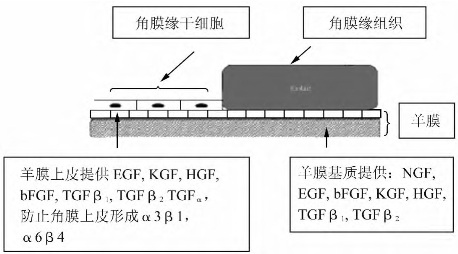
图14-16 羊膜在维持角膜缘干细胞的特性中的作用
Nishida报道应用温度-反应培养皿培养角膜上皮复层,通过降低温度上皮植片自动脱落培养皿,无须载体就可以进行眼表重建,构建角膜也可以采用温度-反应培养皿,直接将扩增的复层上皮接种于构建好的基质上,这将大大简化角膜构建的程序,而且避免了载体的应用,温度敏感培养皿的发明,是组织工程技术上的重大突破,被称为细胞植片工程(Cell sheet engineering),应用这种技术,日本科学家构建出类似肝脏、肾脏等结构复杂的组织。细胞植片移植技术使角膜上皮层的构建摆脱了对于载体的依赖,这将极大地促进组织工程化角膜的发展,为构建组织工程化全层角膜带来希望。
三、角膜内皮重建
Descemet膜具有为角膜内皮细胞载体的潜能。Bohnke等(1998,1999)成功地将人或猪角膜内皮细胞培养在Descemet膜上,并进行了移植试验。Minami,Zieske,Schneider等构建角膜采用的也是动物内皮细胞,人的内皮细胞体外培养已经实现,应用于构建估计为时不远。Bowman膜结构相对比较简单:由纤细的胶原纤维随机排列组成,Descemet膜是内皮细胞产生的精细结构,重建角膜添加内皮细胞以后Descemet膜可以形成。
四、动物移植实验
(一)角膜基质材料的生物相容性实验
通过显微手术将构建的角膜基质材料移植到兔或猴眼角膜基质层间,利用光学显微镜、电镜观察细胞与基质的结合和移植以后的角膜透明度情况,通过特殊染色观察神经的再生情况(图14-17,彩图54),裂隙灯显微镜和组织切片则可检查组织工程化角膜基质的透明性、可降解性以及生物反应性。

图14-17 猪角膜基质植入新西兰白兔角膜层后1个月,神经开始恢复
PLGA作为构建角膜基质的支架材料,实验中将培养的角膜基质细胞接种到PLGA材料上,构建成角膜基质细胞-PLGA复合物,光学显微镜检查发现,角膜基质细胞能与PLGA牢固地结合,材料对细胞没有毒性。细胞-PLGA复合物移植到同纯种兔角膜基质层间后(图14-18,彩图55),开始不透明,移植1周后,复合物的透明度逐渐增加,但是由于降解小分子的作用,4个月左右出现角膜血管新生。裂隙灯及组织切片检查证明,虽然在PLGA降解的过程伴随新生血管增生,但PLGA周围的角膜组织始终保持透明,无任何水肿和免疫排斥反应性炎症。新生血管的产生可能与PLGA降解产物乙醇酸和乳酸有关,由于角膜代谢率低,液体流动差,降解产物乳酸会刺激新生血管形成。另外,组织切片可见,部分接种的细胞增殖后的排列方向按原角膜基质纤维排列的方向塑形,但是结构仍比较零乱,呈半透明状。兔移植实验表明,PLGA不是一种合适的基质构建材料,由于它在降解的过程中会刺激新生血管形成,影响角膜的透明度,因此有待于进一步的改性处理。
图14-18 PLGA复合物移植到兔角膜基质层间
近期,Griffith的研究小组进一步改进了以胶原为主要成分的角膜基质的构建方法。他们利用多种技术交联高浓度的胶原,不但保持了角膜的透明度,而且所获的基质材料机械强度大大增强,接近于眼库角膜。并且对胶原为主要成分的基质复合物进行改进,应用高分子亲水性材料和细胞黏附多肽序列的混合物代替硫酸盐,这些新构建的生物角膜已被用于兔的动物实验手术,术后炎症和免疫反应轻微,并且获得了生物角膜表面的上皮化和神经的再生。
(二)板层角膜的移植实验
构建的板层角膜可以进行重建眼表的试验,首先制备动物眼表损伤模型,然后应用显微板层角膜切削刀去除损伤的板层角膜,最后进行重建的角膜移植实验。光学显微镜、电镜观察上皮细胞生长状况和神经再生,裂隙灯显微镜和组织切片检查组织工程化角膜基质的透明性。利用羊膜为载体构建的角膜上皮层已经开始应用于临床(图14-19,彩图56;图14-20,彩图57),但是由于羊膜透明度不够高,可能传播多种疾病,而且移植后仍然需要进一步的角膜移植,因此羊膜的广泛应用受到一定的限制。

图14-19 羊膜为载体构建的角膜上皮层
Han的研究小组近期成功构建了由人

图14-20 板层角膜重建眼表
类角膜上皮干细胞和交联的纤维素凝胶基质构成的组织工程化眼表组织。他们对人类角膜上皮干细胞进行了体外分离、培养,然后将培养人类角膜上皮干细胞悬浮种植到Ⅷ因子交联的纤维连接蛋白/纤维素凝胶中,培养后细胞向角膜上皮细胞分化,表达AE5抗原。
利用自体角膜缘干细胞构建的板层角膜免疫原性低,是构建板层角膜理想的选择。另外,随着对于成体干细胞的深入研究,角膜缘干细胞的培养建系成为可能,这将为多种构建方案提供充足的种子细胞,从而为角膜疾病的个体化治疗带来希望。
(三)全层角膜的移植
全层角膜的移植条件苛刻,需要合适的内皮细胞,内皮细胞扩增效率低,而且必须达到一定的密度才起正常作用,所以利用自体细胞体外扩增构建角膜难度较大。目前外多采用转染永生化基因的内皮细胞构建角膜内皮层。内皮细胞将是构建全层角膜最后的突破点。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















