6.用光谱仪采集元素的“指纹”
对实验科学来说,光谱仪是最重要的仪器之一。光谱仪的作用在于分解光。它可以分散特定光源的光,就如同雨滴分散阳光现出彩虹,当然它使用的不是雨滴,而是用棱镜(Prism)或光栅。通过光谱仪,光会被分为几种颜色的光谱,再由光谱看出各个光有什么特别的颜色或波长。

锶的化合物在火焰中发出红光
光谱仪的出现,使得科学家们可以通过研究物质放出来的光来区别物质种类,这是一种依光的“指纹”判断原子种类的方法。当初门捷列夫所预言的一种未知元素就是利用光谱仪发现的。
光谱仪的原理
我们可以通过元素发出的光谱颜色来辨别元素的种类。.
铜的化合物在火焰中会发出明亮的绿色光。锶的化合物发出来的则是深红色的光。各种元素发出来的光都是该种元素特有的,所以由那些光可以判断出是哪一种元素。

白色光由光谱仪分散造成由红至紫一连串的光谱
如果要更详细地研究元素发出的光,那么就要使用棱镜或者光栅了。光栅实际上就是棱镜以一定的间隔排列而成的,只是这些棱镜只有在显微镜下才能看得到。
光透过棱镜或光栅会改变方向,也就是折射。折射的角度与光的颜色有关。太阳的白色光是各种颜色的光混合在一起形成的。如果用太阳光做实验,让它透过棱镜,则会发现红色光的折射率最小。
红橙黄绿青蓝紫,越往后,光的折射率越大。即橙黄色比红色的折射率稍微大一点,黄色比橙黄色更大。照这个顺序,绿、青,一直到折射率最大的紫色。这样一来,太阳的白色光就可以分为像彩虹一样包含七种颜色的色光了。

用于光谱仪的弧光灯
碳的光谱包含由红至紫的各种颜色,因此,如果用碳的弧光灯做光源,那么照射出来的光大体上就会是白色。
炭弧光灯的基本部分是由两支直径1厘米的炭条组成的,略间隔相向。照片上的一支炭条横着插在左边,另一支则在下方向上倾斜。两支炭条的前端在金属盖子里面相对,只留有很小的间隔,几乎相接。如照片所示,在金属盖的中央有一个黑黑的洞,这个洞类似窗口,装有深红色的玻璃。透过这个窗口可以看到两支炭条的前端。弧光是向右边发出去的。
从弧光灯发出来的光按顺序要先后通过一个透镜、垂直的细长裂口,再通过另一个透镜,最后会碰到一个方形光栅(请看下页照片)。光透过光栅就被分散成光谱,显现在右边的银幕上。
如果给弧光灯的两支炭条通以强大电流,那么两支炭条的中间部分就会放出很亮的光,我们称之为弧光。这是因为,炭条被通上电流,所产生的热和电流会刺激碳原子,使其电子激发,放出碳特有的光。

分光装置,光由左端的弧光灯出来通过透镜、间隙、透镜、光栅(四角形的)被分散,照在右端银幕上形成光谱。
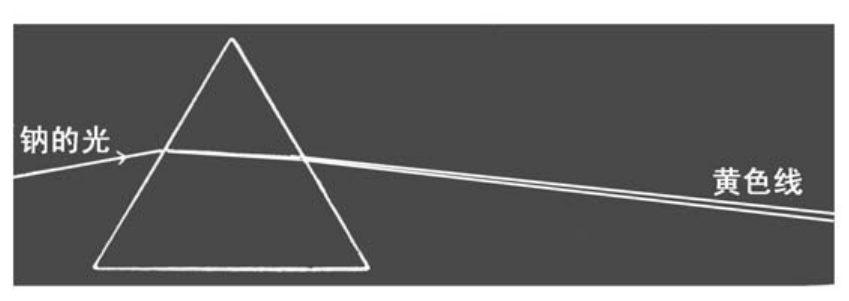
钠的光谱只有黄色线

钠的吸收光谱
如果通电前给任何一支炭条的前端涂上某种元素的溶液,那么该种元素也会与碳同时,发出它特有的光。比如在任意一支碳条的前端涂些钠溶液,这样,钠原子就附在了炭条的前端,那么从弧光灯发出的光谱将是碳与钠光谱的叠加。碳的光谱各色比较均匀,而钠的光谱中黄色部分最强烈(黄色比其他颜色明显)。这这张照片中的光谱并不清楚,但仍可以说明上面谈到的问题。碳的光谱非常均匀,如同太阳的白色光。而给炭条涂上钠溶液之后,光通过光栅,分散成光谱,显示在银幕上,我们很容易就能发现光谱上的黄色部分特别显著。
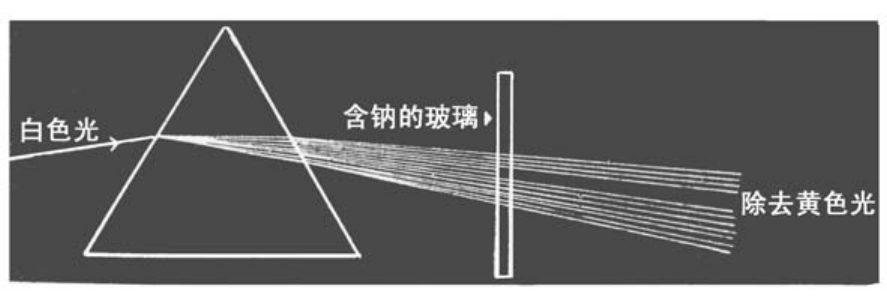
含有钠的玻璃会从白色光中除去黄色光
把这一现象运用到生活中,我们制造出了钠黄色灯———高速公路边的路灯。钠的光被白色或黄色的物质反射,黄色会被加强。但是如果把钠灯的灯罩制成红色,则放出来的灯光就会显示深茶色。这是因为钠的光中缺乏红色系统的光,因此黄色的钠光透过红色,就成了深茶色。
如果附着在炭条前端的是钙原子,那么光谱上也会呈现出钙所特有的颜色。如果我们使钠单独的光通过棱镜或光栅的话,那么现出来的光谱只有很细的黄色线条,而无其他颜色。
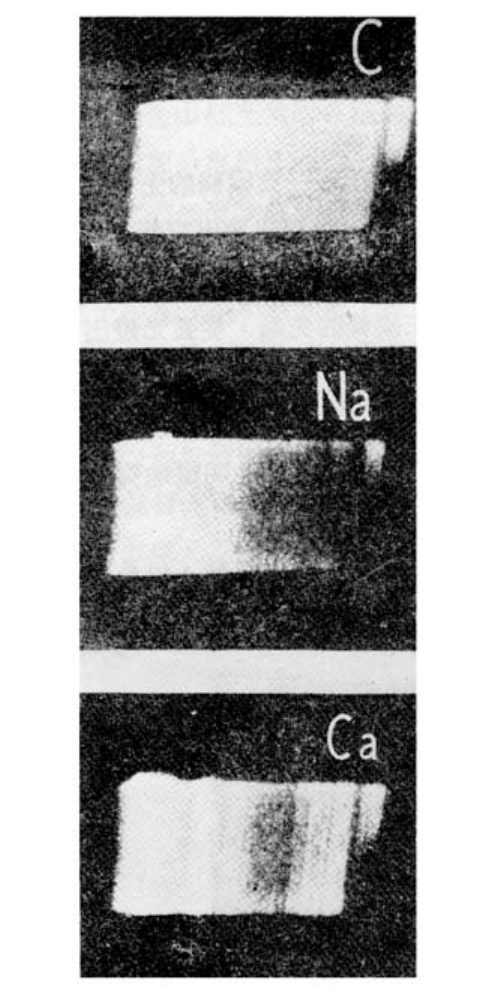
碳的光谱及钠和钙的光谱
吸收光谱
至此我们所说的都是元素的“发光光谱”,就是由元素发出来的光的光谱。相反的,元素还具有一个性质,就是会吸收跟它本身所发出来的光同性质的光。
以钠为例,它本身可以发出黄色光,同时它还可以吸收与之同波长的黄色光。将含钠玻璃板放在弧光灯前面,它会吸收弧光中同波长的黄色光,所以光在通过玻璃时,其中的黄色成分就被过滤了。因此,那些光通过棱镜或光栅以后,我们会发现钠的黄色光消失了。经钠吸收的光谱中,原来钠黄线的位置成了暗线。
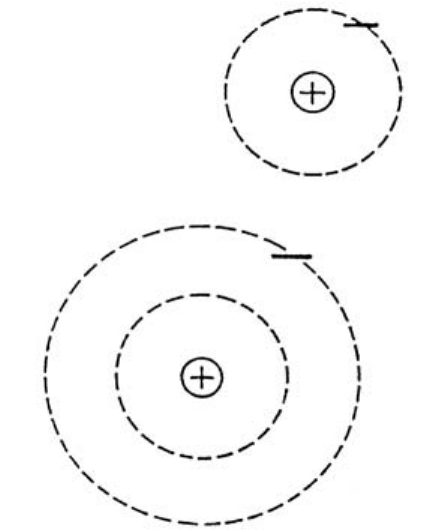
氢原子吸收光后,它的电子会移到外层的轨道(上图),当它回到原来的轨道时会放出光。
换句话说,如果在碳弧光灯和棱镜中间放一个含有钠的玻璃杯,那么钠的光谱就会被吸收,呈现出来的是从碳的光谱中除去钠的部分。这种光谱叫做钠的“吸收光谱”或“暗线光谱”。
因此,可以通过两种方法利用光谱仪辨别元素种类。一是利用原子受到刺激会放出特有的颜色和波长的光。二是利用元素会吸收的光谱。
如此,利用光谱仪不仅可以识别已知元素,还可以发现未知的元素。
首先,光谱仪非常敏锐,即使元素存在的量非常微小,也可以利用它将其识别出来。例如钠元素,即使只存在有十亿分之一克,也可以被分析出来。其次,光谱仪跟距离无关,它可以从太阳或星星射来的光中分辨出组成它们的元素。
那么原子究竟是如何吸收和放出光的呢?这与原子核周围的电子排列有关。
氢的情形最简单。氢的质子数和电子数都为1。原子吸收光时,电子会跳出原来的轨道,到较外面的轨道上去。原子放出光时,是电子从外面的轨道跳回到原来的轨道。锂原子和钠原子的情形与氢原子大体相同。当电子从外面的轨道跳回原来的轨道时,原子会放出它特有的光。
门捷列夫的预言实现
至此,我们可以返回到门捷列夫的预言了。门捷列夫说过,将会有3种新元素来填补他元素周期表上的3个空位,因此,必须要发现这3种新元素。
在门捷列夫预言的五六年后,也就是1875年,法国化学家波瓦布都兰发现了“镓”。波瓦布都兰知道门捷列夫的预言,也知道有关那些未知元素的一切。他在研究锌矿石时,用光谱仪从闪锌矿中发现了一种新元素,并认定这种新元素就是门捷列夫预言的“拟铝”。他以他祖国古罗马的名字Gallia为其命名,把它叫做“Gallium,镓”。
在元素周期表上,镓排在锌的右边。镓和锌的性质很相似,镓原来掺在锌的矿石里面。这说明在元素周期表中,虽然性质相似的元素一般都排在同一直列中,但是也有一些元素,如镓和锌,是排在同一横行相邻的位置的。

门捷列夫
镓是以固体形态存在的,它的熔点很低,仅比室温稍微高一点。所以把装有镓的容器用手捧几分钟,里面的镓就会熔化。
1879年,瑞典的Nilsson又发现了“拟硼”,并将其命名为“Scandium钪,”,取自一个代表北欧的名字Scandinavia。
1886年,德国化学家Winkler发现了门捷列夫所预言的“拟硅”,以德国的名字Germane为其命名,为“Germanium,锗”。
如果将门捷列夫所预言的“拟硅”与新发现的锗在化学性质上做一系列比较,我们就会发现,两者之间存在着惊人的相似性。同样,另外两种元素的化学性质也和门捷列夫的预言非常接近。

*原子容:21克原子所占的体积,就是用密度除原子量的数字
这些都为门捷列夫的天才及其元素周期表的功能做出了充分的证明。门捷列夫非常幸运,他所预言的三种元素在他有生之年都被发现了。
他逝世后,经过半个世纪,第101号的元素在加州大学放射线研究所被发现了,并将其命名为“Merdelevium,钔”,以纪念门捷列夫。
氦的发现
在镓、钪、锗被发现之前,光谱仪就已经成功地帮助人们发现了一种当时没有人预料到的元素———氦。1868年日食的时候,法国天文学家詹桑第一次使用光谱仪分析了从彩层发出来的光,所谓彩层就是太阳发光的大气层。光谱上有三条黄色的线,其中的两条很快就被认出是钠特有的线。而另外一条线从来没有人看到过,不过可以肯定的是,它也属于某种元素。
大家很快达成了共识,认为这条特殊的线来自于太阳中某种未知的元素,并将其命名为“Helium,氦”,取自太阳的希腊名Helios。27年之后,人们才知道氦并不是太阳上特有的元素,在地球上也是存在的。

在太阳光谱中发现的氦的光谱线(箭头)
稀有气体元素的探求
可是在19世纪70~80年代,门捷列夫的元素周期表上还没有地方可以容纳氦元素。
化学家们在地球上发现氦,并因此修改了元素周期表,并不是因为得到了在太阳中发现氦的启示,事实上两者之间几乎不存在关联。Rayleigh 在19世纪80年代是英国剑桥大学的物理教授。很早以前他就开始研究气体密度,尤其对氮有浓厚的兴趣。他发现由氨造出的氮比从空气中抽出的氮密度小0.5%。
为什么?
实际上这些差别太小,大部分人都没把它当回事。但是化学家Ramsay认为值得研究。Ramsay在一定量的空气中先后除去氧和氮,空气并不只是由这两种元素构成的,在除去氧和氮之后还会剩下些气体。他把剩下的气体装入玻璃管,再通上电流去刺激它。用光谱仪来观察气体放出来的光谱,他发现光谱上的线不属于任何已知的元素。非常奇怪的是,当时的元素周期表上没有空位可容纳这种新元素。
到了1894年,Ramsay突然意识到,元素周期表可能缺少了一列。在门捷列夫的时代,人们还没有发现任何一个属于这一直列的元素,所以一代大化学家做梦也不会想到他的元素周期表还少了一列。
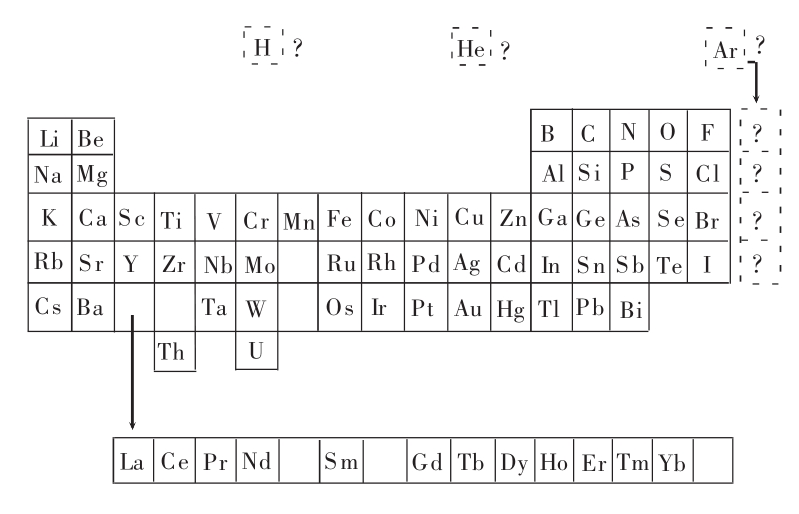
Ramsay想,他所发现的新元素可能就是那一列的头一个。上表显示的是当时所知道的元素在今天元素周期表中的排列。
Ramsay把新发现的元素叫做“argonium,氩”,取自希腊语,是“懒怠者”的意思。这是因为看起来,氩似乎完全没有化学活性,它无臭、无色、无味,也不跟其他元素发生化学反应。
第二年,Ramsay在加热一种叫做克列布的罕有矿石时,发现从矿石中飞出一种气体。他研究这种气体的光谱,发现它跟太阳中的氦完全一致。Ramsay在其年轻助手特拉巴史的协助下继续研究空气,不久便成功地从空气中分离出了氦。Ramsay及其助手认为应该还存在类似氩和氦的气体,他们继续寻找,并且成果显著。
液态空气中各元素的沸点都不同,因此可以使其沸腾而把各种元素分离,我们将这种方法称为分馏。如液态空气中的氮会比氧早沸腾而蒸发掉。我们从原油中分离汽油或灯油成分,所采用的基本方法就是分馏。
Ramsay及其助手就是使用这个方法分离液态空气成分的。他们两位分离出气体成分之后,再将其放进放电管用电流刺激,元素受到刺激会放出其特有的光。他们利用光谱仪对这些光做出分析,察看有没有分离出新的元素。这样很快就有三种新元素被发现了,它们被命名为“Neon,氖(新东西)”“Krypfon,氪(隐藏着的东西)”和“Xenon,氙(没见过的东西)”。
![]()
这三种气体的化学性质跟氦及“懒怠者”氩一样,都完全不跟其他任何元素化合。现在我们将这类气体称为“稀有气体”或“惰性气体”。
1900年,特伦发现了最后一种稀有气体元素。大家都知道,铀在放出射线的时候,会产生一种气体。特伦认出它是稀有气体的最后一种,同时因为它具有放射性,因此又是稀有气体中最重的一种。这在特伦之前是没有人发现的。他将这种气体命名为“Radon,氡”。
利用稀有气体
惰性气体的用途也比较广泛,大部分情况下人们利用的都是它们不跟其他元素起反应的特性。氦最初在军事上的应用就使英国人大吃了一惊。德国Zeppelin飞船在空袭英国的时候,中了英国的发火弹却安然无事,并未爆炸。这是因为飞船所用的气体是不会燃烧的氦,而不是容易燃烧的氢。
氦的重量仅重于氢,是第二个最轻的元素。可是性质跟氢不同。今天,我们已经不再用氧和氮的混合气体供潜水人员在水中呼吸,而是用氦替换了氮。这是因为氮溶于血液,当潜水人员从水深处急剧浮上水面时,由于压力的骤减,溶于血液中的氮会变成气泡而蒸发,从而导致微血管堵塞,引起所谓的潜水病。氦则不太溶于血液,不会引起潜水病。
一种元素是可以转变成另外一种元素的。Ramsay曾经做过实验证明了这一点。1903年,他发现镭衰变时会放射出氦。这是证明元素间可以转化的初期实验之一。今天,氦的原子核被用于原子核破坏装置,冲击原子核的子弹。氦原子核,即不包含电子的氦原子,由两个中子和两个质子构成,我们又称其为“阿尔法粒子”,它是放射能中很普遍的一种产物。
氩还可用于金属熔接。因它不跟其他元素化合,所以在熔接时可以防止金属氧化———燃烧或生锈。另外氩还被用于盖氏计数管及节能灯。
氩、氖及其他一部分惰性气体都是霓虹灯的基本材料。制作霓虹灯时,先在玻璃管内涂上荧光物质,它们可以发出所需颜色。然后放进适量的惰性气体混合物,再通上电源使其放电,就是大众所熟悉的霓虹灯了。
为什么稀有气体不会化合
这些气体都很轻,并且没有化学活性,这是它们的本质。大部分情况下,它们不会跟其他元素化合或产生反应。(1962年合成了氙和氟的化合物,后来又发现氪和氡可以发生一点点化学反应。)
惰性气体原子的电子构造决定了它们不具有任何化学活性。
钠原子共有三层电子轨道,第一层轨道上有2个电子,第二层转道上有8个电子,第三层轨道上只有1个电子。钠的性质很活泼,是一种非常危险的元素,需要特别小心。类似钠这种最外层轨道上只有一个电子的元素,化学性质都很活泼。
在元素周期表上,氖排在钠的前面。氖与钠不同,最外层轨道上不存在单独的电子。所以氖原子的电子位置如下图所示。第一层轨道上有2个电子,第二层轨道上有8个电子,两个轨道都不存在空位。因此它没有余地让其他电子进来,也没有电子可以进入其他原子的电子轨道。所以它没有化学活性。
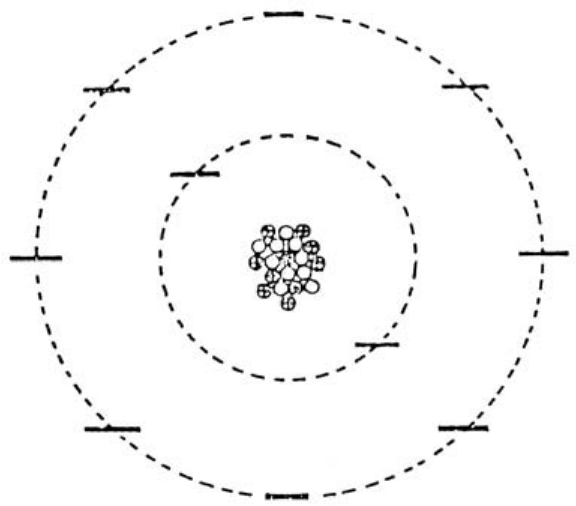
氖的原子模型
氟比氖少一个电子,第二层轨道上的电子是7个,这样就有了一个空位,可以让其他原子(如钠)多余的一个电子进入。氟会拼命找多余的一个电子来填补它本身的那个空位,因此,氟的性质很活泼。跟钠一样,氟也是最易反应的元素之一。
惰性气体,又被称为稀有气体,所谓“稀”,即表示地球上罕有,所以到了最近才被发现。这些稀有气体在元素周期表上恰好排满了一个直列,这是门捷列夫没有预言到的。
元素周期表的完结
在那段时期里,门捷列夫所预言的“镓(Ga)”“钪(Sc)”“锗(Ge)”和属于“稀土”类的八种新元素都被陆续地发现了。“钇(Y)”———1878年,“钐(Sm)”“钬(Ho)”“铥(Tm)”———1879年,“镨(Pr)”“钕(Nd)”———1885年,“钆(Gd)”“镝(Dy)”———1886年。
“钋(Po)”及“镭(Ra)”于1898年被发现。1899年发现“锕(Ac)”,1901年发现“铕(Eu)”,1907年发现“镥(Lu)”,1917年发现“镤(Pa)”。
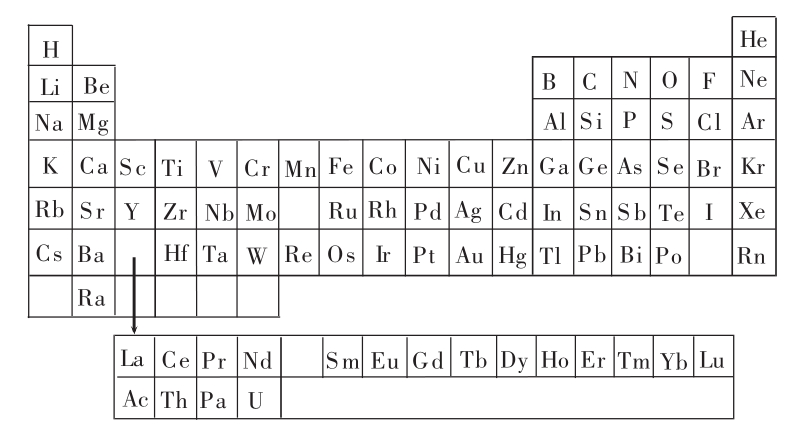
我们将镧及其他14种“稀土”类元素通称为镧系元素,在元素周期表上排列在钡和铪的中间。为了方便,我们将其在元素周期表的下方单独列了一横行。它们与过去被叫做“土”的石灰或氧化镁很相像,因此被称为“稀土”类元素。
锕及其锕系元素,钍、铀等被排在了镧系元素下面的另一横行。每一种锕系元素都类似于锕,同时,每一种锕系元素与排在自己上方的对应的镧系元素很相似。
“铪(Hf)”和“铼(Re)”分别于1923年与1925年被发现。此时至铀为止的元素周期表基本完成了,只剩下四个空位。
元素周期表是按照原子序数的顺序排列元素的。原子序数等同于原子核中正电荷数,或者原子核周围负电荷数。
元素周期表横行叫做周期。第一周期只有两种元素———氢和氦。第二、第三周期各有8种元素。第四和第五周期各有18种元素。
第六周期共有32种元素,其中14种是镧系元素。现在的元素周期表,根据理论,准备将第七周期给18种元素和14种锕系元素。这是对1925年元素周期表的扩充。
在元素周期表中,化学性质相似的元素会由上而下排成一直列。如左边第一直列有氢、锂、钠等“碱金属”。第三直列有钪、钇和全部镧系元素及全部锕系元素。
稀有气体在元素周期表上位于最右边一族。右边第二直列有氟、氯等卤族元素。该族元素最外层的电子轨道上都有一个空位。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















