实验3 酸碱标准溶液浓度的标定
实验目的
(1)学习酸碱标准溶液浓度的标定方法;
(2)进一步熟悉称量技术和巩固滴定操作。
实验原理
酸碱标准溶液是采用间接法配制的,其准确浓度必须依靠基准物进行标定。只要标定出酸碱溶液中任何一种的浓度,即可根据体积比VHCl/VNaOH计算出另一种溶液的浓度。
1.酸标准溶液浓度的标定
无水碳酸钠和硼砂等常用作标定酸的基准物质。用无水碳酸钠标定时,先于180℃干燥2~3h,然后置于干燥器内冷却备用。标定反应如下:
![]()
当反应达到化学计量点时,溶液的pH值为3.9,可用甲基橙作指示剂。用硼砂(Na2B4O7·H2O)标定酸时,其反应如下:
![]()
化学计量点时反应产物为H3BO3(Ka1=5.8×10-10)和NaCl,溶液的pH值为5.1,可用甲基红作指示剂。
硼砂的制作方法为:在水中重结晶(结晶析出温度在50℃以下),析出的晶体于室温下曝露在60%~70%相对湿度的空气中,干燥24h,即可获得符合要求的硼砂。干燥的硼砂结晶须保存在密闭的瓶中,以防失水。
2.碱标准溶液浓度的标定
标定碱溶液时,常用邻苯二甲酸氢钾和草酸作基准物质进行标定。
邻苯二甲酸氢钾(KHC8H4O4)易得到纯品,在空气中不吸水,容易保存;它与NaOH起反应时物质的量之比为1∶1,其摩尔质量较大,因此是标定碱标准溶液较好的基准物质。标定反应如下:
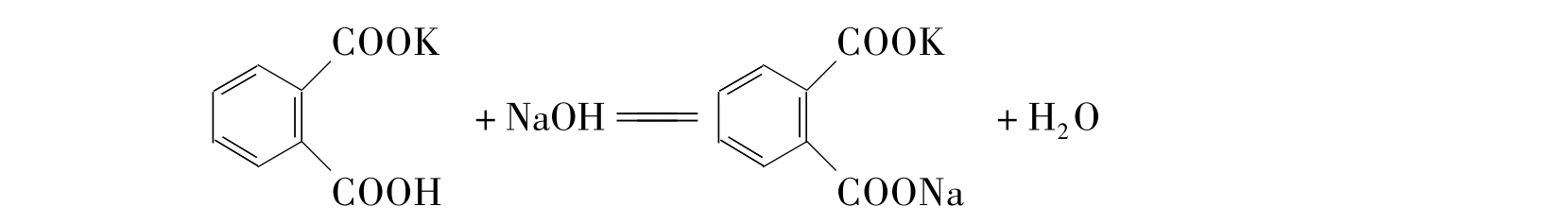
若NaOH的浓度为0.1mol·L-1,化学计量点时溶液呈微碱性(pH值约为9.1),可用酚酞作指示剂。
邻苯二甲酸氢钾通常于100~125℃温度下干燥2h后备用。干燥温度不宜过高,否则会引起脱水而成为邻苯二甲酸酐。
草酸(H2C2O4·2H2O)相当稳定,相对湿度在5%~95%时不会风化失水。标定反应为:
![]()
化学计量点时溶液略偏碱性(pH值约为8.4),pH值突跃范围为7.7~10.0,可选用酚酞作指示剂。
配制H2C2O4溶液时,水中不应含有CO2。光和催化作用(尤其是二价锰)能加速空气对溶液中H2C2O4的氧化作用。草酸也会自动分解为CO2和CO。因此应该妥善保存H2C2O4溶液(放置暗处)。
仪器与药品
仪器:分析天平、酸式滴定管、碱式滴定管、锥形瓶、量筒。
药品:0.1mol·L-1HCl标准溶液、0.1mol·L-1NaOH标准溶液、无水Na2CO3(基准物质)、邻苯二甲酸氢钾(基准物质)、0.1%甲基橙指示剂、0.1%酚酞指示剂。
实验步骤
以下标定实验,可根据后面要分析的试样,选择其中的一种。
1.HCl标准溶液的标定
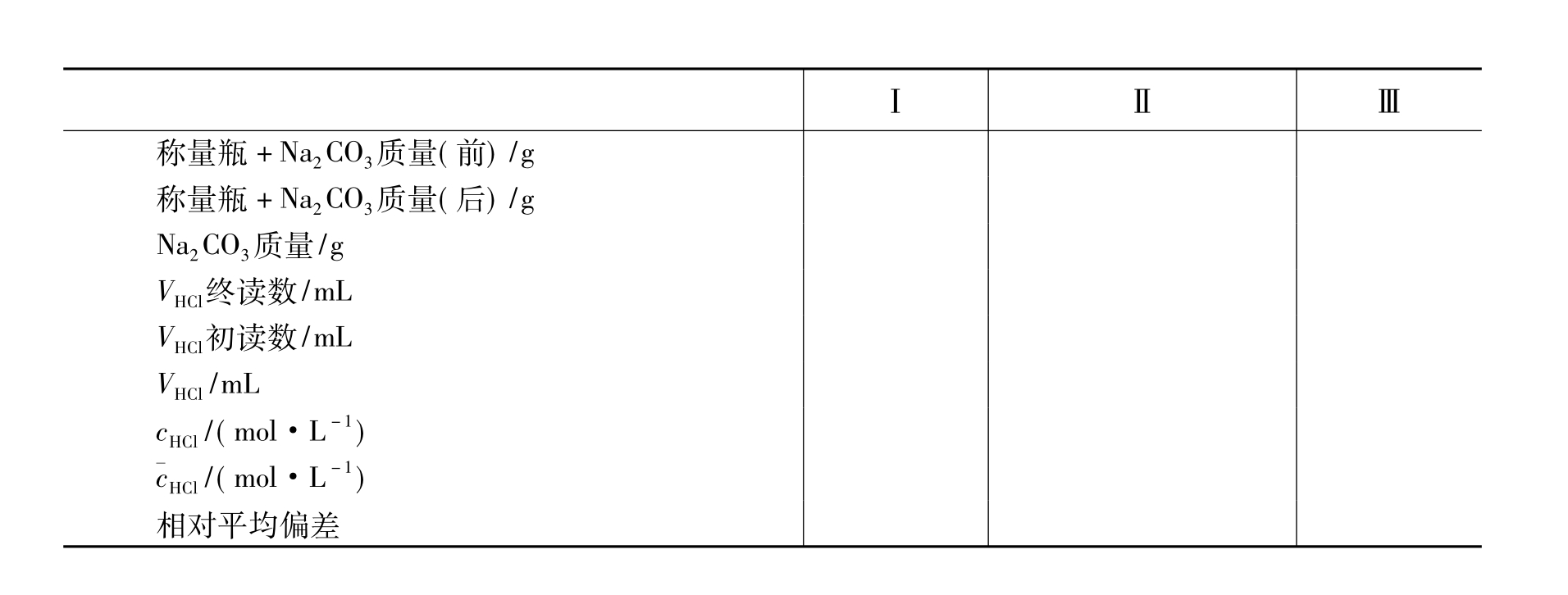
在分析天平上用差减法准确称取0.11~0.17g无水Na2CO33份(其质量按消耗20~30mL0.1mol·L-1HCl计),分别置于已标好号的3只250mL锥形瓶中,各加水50mL,溶解后各加入一滴甲基橙,分别用欲标定的HCl溶液滴定。边滴边摇,近终点时应逐滴或半滴加入,直至滴加半滴或一滴HCl,恰使溶液由黄色转变为橙色即为终点①。记下滴定管读数。用同样方法滴定另外两份Na2CO3。
根据Na2CO3的质量和所消耗的HCl溶液的体积计算出HCl标准溶液的浓度,求出3份标定结果的相对平均偏差应小于0.3%。
数据记录
2.NaOH标准溶液的标定
在分析天平上用差减法准确称取0.4~0.6g邻苯二甲酸氢钾3份(其质量按消耗20~30mL0.1mol·L-1NaOH计),分别置于已标好号的3只250mL锥形瓶中,各加50mL水,温热使之溶解。冷却后在其中一只锥形瓶中加两滴酚酞指示剂,用欲标定的NaOH溶液滴定,边滴定边摇动锥形瓶,直到溶液由无色变为微红色,并在30s内不褪色即为终点②,记下滴定管读数。用同样的方法滴定另外两份。
根据邻苯二甲酸氢钾的质量和所消耗NaOH的体积计算NaOH的浓度。要求各次标定的结果与平均值的相对偏差不得大于0.3%,否则应重做。数据记录格式参阅HCl溶液的标定过程自己设计。
注释
①用无水Na2CO3标定HCl时,反应本身由于产生H2CO3,会使滴定突跃不明显,致使指示剂颜色变化不够敏锐,因此,在接近滴定终点之前,最好把溶液加热至沸,并摇动以赶走CO2,冷却后再滴定。
②标定NaOH溶液时,以酚酞为指示剂,终点为粉红色,半分钟不褪。如果经较长时间,粉红色慢慢褪去,是溶液吸收了空气中的CO2生成H2CO3所致。
思考题
(1)如何计算称取基准物Na2CO3或邻苯二甲酸氢钾的质量范围?称得太多或太少对标定有何影响?
(2)作为标定的基准物质应该具备哪些条件?
(3)溶解样品时所加水的体积是否需要准确量取?为什么?
(4)用Na2CO3作基准物标定HCl时,为什么用甲基橙作指示剂?能用酚酞吗?为什么?
(5)用邻苯二甲酸氢钾标定NaOH时,为什么用酚酞而不用甲基橙作指示剂?
(6)无水Na2CO3如果保存不当会吸有少量水分,对标定HCl溶液的浓度有何影响?写出HCl标准溶液浓度的计算公式。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















