醇的通式为R—OH,羟基(—OH)是醇的官能团,醇也可看作是水分子的一个氢原子被脂肪烃基取代后的生成物。以最简单的醇——甲醇CH3OH为例,其C—O—H键的键角为108.9°,故认为醇羟基的氧原子为不等性sp3杂化,如图6-1所示。由于氧的电负性较强,所以醇分子中的C—O键和O—H键都有较强的极性,醇的极性对其物理性质和化学性质均有较大的影响。
图6-1 甲醇的结构示意图
醇的化学性质主要由其官能团决定,而反应活性则受烃基的影响。
醇分子中的C—O和O—H键都是极性很强的键,易受到外来试剂的进攻,是反应的主要部位。此外,由羟基所产生的诱导效应增强了α-H和β-H的活性,也会发生或参与某些反应。
1.羟基中氢的反应(犗—犎键的断键)
(1)与活泼金属的反应 在醇分子中,由于氧原子的电负性较强,故羟基中的氢与水中的氢类似,可以被金属钠取代生成氢气,醇则生成相应的醇钠:
HO—H+ →Na Na OH+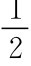 H2↑ 剧烈反应,放热,自燃
H2↑ 剧烈反应,放热,自燃
RO—H+ →Na RONa+ H2↑ 反应缓和,放热,不自燃
H2↑ 反应缓和,放热,不自燃
醇羟基中的氢原子不如水分子中的氢原子活泼,当醇与金属钠作用时,比水与金属钠作用缓慢得多,而且所产生的热量不足以使放出的氢气燃烧。据此,某些反应过程中残留的钠可用乙醇来处理。
由于烃基是给电子基团,叔醇的羟基受到三个给电子基团的影响,使氧原子上的电子云密度较高,相应地,氢原子和氧原子结合得也较牢,而伯醇的羟基只受到一个给电子基团的影响,氧原子上的电子云密度较低,氢原子受到的束缚力较小,所以不同类型的醇与金属钠反应的活性顺序是:
水>甲醇>伯醇>仲醇>叔醇
由于醇的酸性比水的弱,其共轭碱烷氧基(RO-)的碱性就比OH-的强,所以醇盐遇水会分解为醇和金属氢氧化物。在有机反应中,烷氧基既可作为碱性催化剂,也可作为亲核试剂进行亲核加成反应或亲核取代反应。
RONa+H2O→ROH+Na OH
醇和金属镁、铝等也能反应,生成醇镁或醇铝:
2C2H5OH+Mg I→2(C2H5O)2Mg+H2↑
异丙醇铝、叔丁醇铝在有机合成中都是重要的化学试剂。
(2)与酸的成酯反应 醇和酸作用生成酯的反应称为酯化反应。无机含氧酸和有机酸均可以与醇酯化。醇与无机含氧酸酯化,可得到无机酸酯,例如:
硫酸二甲酯是无色油状有刺激性的液体,有剧毒,使用时应小心。它和硫酸二乙酯在有机合成中是重要的甲基化和乙基化试剂。
甘油与硝酸通过酯化反应可制得三硝酸甘油酯。三硝酸甘油酯俗称硝化甘油,是一种炸药。其在临床上用于血管舒张,治疗心肌梗死和胆绞痛。
醇与有机酸的酯化是可逆的,在一定条件下达到平衡。
提高酯化反应产率的方法众多,将在羧酸章节具体讨论。而工业上一般将生成的酯和水蒸馏出去,使平衡向正方向移动,从而提高酯的产率。
(3)邻二醇与氢氧化铜的显色反应 多元醇具有一定的酸性和配位能力,其中邻二醇与新制备的Cu(OH)2反应,可以生成绛蓝色溶液,而非邻二醇则没有此现象。因此,该反应属邻二醇的特征性反应,常被用于鉴定邻二醇结构的多元醇。
思考题6-3 写出1-丁醇、2-丁醇和2-甲基-2-丙醇的构造式,并比较与金属钠反应的活性顺序,再比较相应的醇钠的碱性大小次序。
2.羟基被卤原子取代(犆—犗键的断裂)
醇的羟基可以与HX、PX3、PX5或SOCl2(亚硫酰氯或氯化亚砜)等反应而被卤素取代,生成卤代烃。
(1)与氢卤酸反应 醇与氢卤酸作用,羟基被卤素取代而生成卤代烃和水:
ROH+HX幑幐
RX+H2O
这个反应是可逆的,酸的性质和醇的结构都影响这个反应的速度。HX的活性次序是:HI>HBr>HCl。
醇的活性次序是:烯丙型醇和苄醇>叔醇>仲醇>伯醇。
CH3CH2CH2CH2OH CH3CH2CH2CH2I
CH3CH2CH2CH2I
CH3CH2CH2CH2OH CH3CH2CH2CH2Br
CH3CH2CH2CH2Br
CH3CH2CH2CH2OH CH3CH2CH2CH2Cl
CH3CH2CH2CH2Cl
同样的伯醇,与浓HI作用,加热即可生成碘代烃;与浓HBr作用,必须在H2SO4存在下加热才能生成溴代烃;与浓HCl作用,必须有Zn Cl2作为催化剂才能生成氯代烃。
将浓盐酸和无水氯化锌所配的溶液称为卢卡斯(Lucas)试剂,六个碳以下的一元醇可以溶解在这个试剂中,而生成的卤代烃因不溶而变得混浊,根据呈现混浊的快慢即可鉴别不同的醇。注意此反应的鉴别只适用于含六个碳以下的伯、仲、叔醇异构体,这是因为高级一元醇也不溶于卢卡斯试剂。例如:
R3COH+HCl(Zn Cl2 R3CCl+H2O (立即浑浊)
R3CCl+H2O (立即浑浊)
R2CHOH+HCl(Zn Cl2 R2CHCl+H2O (数分钟浑浊)
R2CHCl+H2O (数分钟浑浊)
RCH2OH+HCl(Zn Cl2 无现象
无现象
(2)与卤化磷(PX3、PX5)反应 醇与PX3反应,生成相应的卤代烃和亚磷酸,此反应不易发生重排,产率较高,是制备溴代烃和碘代烃的常用方法。氯代烃常用PCl5与醇反应制备:
(3)与亚硫酰氯(氯化亚砜)反应 亚硫酰氯SOCl2(氯化亚砜)和醇反应,可直接得到氯代烃,同时生成二氧化硫和氯化氢两种气体,易于分离。
这是制备氯代烃的常用方法,此反应不仅速率快,反应条件温和,产率高,而且不生成其他副产物。
思考题6-4 某些醇和氢卤酸作用易发生重排,为了防止重排,应选用什么卤化剂?
思考题6-5 如何鉴别1-丁醇、2-丁醇和2-甲基-2-丙醇?
3.脱水反应
醇的脱水反应有两种方式:一种是分子内脱水生成烯烃,另一种是分子间脱水生成醚。
(1)分子内脱水 醇与脱水剂(浓硫酸、三氧化二铝)共热能发生脱水反应。醇的脱水反应是制备烯烃常用方法之一。
结构不同的醇分子内脱水难易程度是不一样的。例如:
伯、仲、叔醇脱水由易到难的顺序是:叔醇>仲醇>伯醇。
醇的脱水与卤代烃的脱卤化氢一样,遵循查依采夫规则,即从含氢数目较少的β碳原子上消除氢。但是对某些不饱和醇脱水时,首先要考虑的是能否生成含稳定的共轭体系的烯烃。例如:
有的醇在进行E1消除脱水时会产生重排产物,例如:
但是在Al2O3催化下,很少发生重排,并且Al2O3经再生后可重复使用,但反应温度较高。例如:
(2)分子间脱水 醇在相对较低的温度下加热进行分子间的脱水反应生成醚。例如,乙醇在140℃时在浓H2SO4的作用下主要发生分子间脱水生成乙醚:
其反应历程是:首先生成质子化的醇,然后由另一分子醇中带部分负电荷的氧进行亲核取代反应生成醚:
如果是仲醇或叔醇,反应可按SN1历程进行。
由此可见,醇的分子内脱水和分子间脱水其实就是消除反应和亲核取代反应之间的竞争,一般情况下,高温有利于分子内脱水生成烯,低温有利于分子间脱水生成醚。而叔醇脱水只生成烯烃,不会生成醚,因为叔醇消除倾向大。
4.氧化反应
醇分子中由于羟基的影响,使α-氢较活泼,容易发生氧化反应。伯醇和仲醇由于有α-氢存在,容易被氧化,而叔醇没有α-氢,难氧化。不同类型的醇得到不同的氧化产物。
(1)强氧化剂氧化 酸性高锰酸钾和酸性重铬酸钾是常用的氧化剂。伯醇首先氧化成醛,醛能继续被氧化为酸,仲醇氧化生成含相同数碳原子的酮。
叔醇分子中不含α-H,一般反应条件下不被氧化;若在强烈条件下氧化(如在酸性条件下加热),原料首先脱水生成烯烃,烯烃再被氧化成小分子化合物。如:
上述氧化剂氧化醇时,反应前后有明显的颜色变化。如采用K2Cr2O7的硫酸溶液为氧化剂,氧化前后溶液的颜色将由六价铬(Cr6+)的橙黄色还原为三价铬(Cr3+)的绿色,因此,可根据溶液颜色的变化来区别伯醇(仲醇)和叔醇。此外,检测汽车驾驶员是否饮酒的呼吸分析仪就是根据醇能被K2Cr2O7氧化而设计的,最低限80mg。
(2)其他选择性氧化剂氧化 沙瑞特(Sarrett)试剂氧化:Cr O3和吡啶的配合物能迅速将伯醇氧化成醛、将仲醇氧化成酮,产率高,而且对双键无影响。例如:
琼斯(Jones)试剂氧化:该试剂是将Cr O3溶于稀H2SO4中,然后滴加到被氧化醇的丙酮溶液中,分子中的碳碳双键不受影响,且产率较高。
(3)脱氢氧化 伯醇、仲醇的蒸气在高温下通过催化剂活性铜时发生脱氢反应,生成醛或酮:
脱氢反应是可逆的,为使反应完全,往往通入空气,使氢氧化成水。目前工业上由甲醇制备甲醛,乙醇制备乙醛都采用这种方法。
叔醇分子中没有α-氢,不能脱氢,只能脱水生成烯烃。
思考题6-6 完成下列反应。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















