溶液浓度的表示方法很多,最常用的有下列几种。
(一)质量摩尔浓度
质量摩尔浓度(molality):设溶液中各物质为A、B、C…,通常视量较多的A为溶剂,若溶质B的量以mol表示,则【溶质B的物质的量nB(mol)与溶剂的质量mA(kg)之比,称为溶质B的质量摩尔浓度,用符号bB表示】。
质量摩尔浓度的SI单位为mol·kg—1。
若溶质仅有一种,则溶质的浓度可称为溶液的浓度。若溶质有几种,则溶液的浓度为几种溶质的浓度之和。
【例4-1】32.2g芒硝(Na2SO4·10H2O)溶于150g水中,求溶液的质量摩尔浓度。
解:Na2SO4·10H2O的摩尔质量为322g·mol—1。
Na2SO4的摩尔质量为142g·mol—1。
(二)物质的量浓度
物质的量浓度(amount of substance concentration),简称浓度,其定义为【溶质B的物质的量nB(mol)与溶液的体积V之比,用符号cB表示】。
物质的量浓度的SI单位为mol·m—3。由于立方米的单位太大,不大适用,化学计算中常用单位为mol·L—1或mol·dm—3。
在很稀的水溶液中,可近似认为物质的量浓度cB与质量摩尔浓度bB相等,这是因为在很稀的溶液中,溶质的质量可以忽略不计,水的密度可视为1kg·L—1,则水的体积与水的质量相等。
广义地说,气体混合物也可视为气体溶液,其物质的量浓度的定义与液态溶液的一致,体积为气体的体积。
【例4-2】将12.6g草酸晶体(H2C2O4·2H2O)溶于水中,使之成为体积为200ml的溶液,求溶液的物质的量浓度。
解:H2C2O4·2H2O的摩尔质量为126g·mol—1。
H2C2O4的摩尔质量为90.0g·mol—1。
(三)摩尔分数
摩尔分数(molefraction):【混合物中物质B的物质的量nB(mol)与混合物的总量n总之比,用符号xB表示】。即
摩尔分数的SI单位为1。
显然,溶液中各组分摩尔分数之和等于1,即∑ixi=1
这是因为
【例4-3】将10gNaOH溶解在90g水中配成溶液,求该溶液中NaOH和水的摩尔分数各为多少?
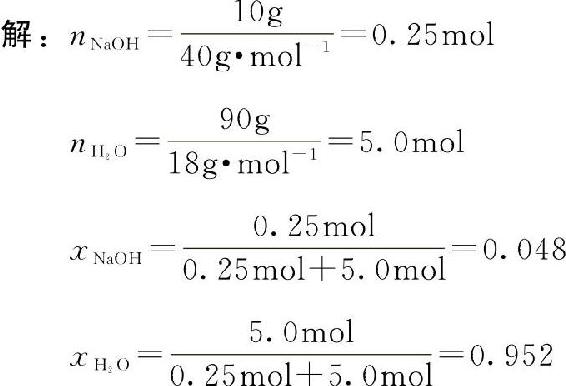
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















