2.1.4 理想气体的压强和温度的统计解释
1.压强的微观意义
从气体动理论的观点来看,气体中的大量分子处于无规则的、永不停息的热运动中,它们不断地与容器器壁发生碰撞,在碰撞中给器壁以冲力的作用。对一个分子来讲,它与器壁发生碰撞的时间和空间位置以及碰撞中给予器壁的冲力大小是随机的、不确定的;但对大量分子来讲,每时每刻都有许多分子与器壁发生碰撞,它们给予器壁的冲力表现为持续不断的、恒定的平均作用力。所以气体的压强是大量分子对器壁不断碰撞的平均集体效果,是一个统计平均量。气体的压强在数值上应等于单位时间内与器壁单位面积发生碰撞的所有分子给予器壁的总冲量的统计平均值。
理想气体的压强公式为
![]()
式中:n为单位体积分子数;m为一个分子的质量; 是分子速率平方的平均值;
是分子速率平方的平均值; 为气体分子的平均平动动能。由于
为气体分子的平均平动动能。由于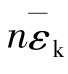 表示单位体积中的分子平均平动动能,因此压强是大量气体分子平均平动动能密度的量度,这是压强的微观意义。
表示单位体积中的分子平均平动动能,因此压强是大量气体分子平均平动动能密度的量度,这是压强的微观意义。
单位体积分子数n和分子的平均平动动能 都是微观量,不能经过实验直接测量,而压强是宏观量,可以直接测量。理想气体的压强公式揭示了宏观量与微观量之间的联系。
都是微观量,不能经过实验直接测量,而压强是宏观量,可以直接测量。理想气体的压强公式揭示了宏观量与微观量之间的联系。
2.温度的微观意义
将理想气体的压强公式p= 与理想气体的状态方程p=nkT比较,可得
与理想气体的状态方程p=nkT比较,可得
![]()
由此可知,气体的温度是大量气体分子平均平动动能的量度,这是温度的微观意义。平均平动动能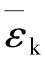 对应分子热运动的强度,因此也可以说,温度是大量气体分子热运动强度的量度。因为
对应分子热运动的强度,因此也可以说,温度是大量气体分子热运动强度的量度。因为 是统计平均值,所以温度也具有统计的意义。
是统计平均值,所以温度也具有统计的意义。
平均平动动能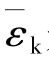 是不能直接测量的微观量,而温度是可以直接测量的宏观量,上式揭示了宏观量与微观量之间的又一联系。
是不能直接测量的微观量,而温度是可以直接测量的宏观量,上式揭示了宏观量与微观量之间的又一联系。
由上式可知,对任何理想气体,只要温度相同,则它们的平均平动动能就相同,而与气体的种类无关。
【例2.1-1】一个容器内贮有1mol氢气和1mol氩气,当气体处于平衡态时,若氢气对器壁的压强为p1,氩气对器壁的压强为p2,则两者的关系是( )。
(A)p1>p2 (B)p1<p2 (C)p1=p2 (D)不能确定
解:氢气和氩气都是1mol,处于同一容器,所以两者的分子数密度相等,即n1=n2= 又因为气体处于平衡态,温度一定,两气体的平均平动动能相等,即
又因为气体处于平衡态,温度一定,两气体的平均平动动能相等,即 。根据理想气体压强公式p=
。根据理想气体压强公式p= 可知,p1=p2,正确答案为(C)。
可知,p1=p2,正确答案为(C)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















