11.2 离子敏传感器
离子敏传感器(Ion Sensor)是指具有离子选择性的一类传感器,它能检测出溶液中离子的种类、浓度(严格讲是离子的活度[1])。最简单的离子敏传感器是离子选择电极(ISE)。大约在20世纪80年代,由于半导体制造技术的发展,由日本清山、哲朗等人首先将离子选择电极与场效应晶体管(MOSFET)技术结合,研制出具有离子选择性场效应管型离子敏传感器(ISFET)。
11.2.1 离子敏传感器的结构与分类
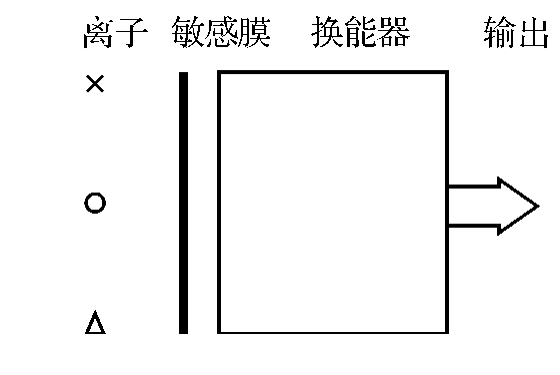
图11-1 离子敏传感器结构图
离子敏传感器的结构如图11-1所示。其中,敏感膜的作用是选择待测离子,是接受器;换能器的作用是将待测离子的活度转换为电信号。敏感膜和换能器是化学传感器的关键,其形式决定了离子敏感传感器的类型。因此可以根据敏感膜和换能器将离子型传感器分类。
(1)按敏感膜分有:玻璃膜式、固态膜式、液态膜式离子敏传感器。
(2)按换能器分有:电极型、场效应管型、光导纤维型、声表面波型离子敏传感器。
其中玻璃膜和固态膜类型应用最广,最易与各种换能器结合;而换能器中,离子选择电极应用最广。但目前发展最多最快的是场效应管型离子敏传感器(ISFET)。这一方面得益于近年飞速发展的硅半导体制造技术,另一方面由于这种传感器性能可靠,应用方便,易于集成化,因而很受欢迎。本节主要介绍这两种离子敏传感器。
11.2.2 离子敏传感器离子选择原理
1.原电池和能斯特(Nernst)方程
将化学能转变为电能的装置称为原电池,如图11-2所示。两个金属棒(如铜棒、锌棒)插在适当的电解质溶液中(如CuSO4,ZnSO4),就成为电池的两个电极;每个电极浸入电解质溶液中就构成一个半电池。这时,金属棒表面会吸附溶液中的金属离子,同时,金属棒上的原子也会溶入溶液中,两者最终达到平衡;在金属棒与溶液接触表面产生的界面电势,称为电极电位,它与离子的种类和溶液的浓度有关。用导线将两个电极连通,通过毫伏表可以观察到导线中有电流流过,这表明两个半电池的电极电位不相等,金属中的自由电子沿导线流动。同时可以观察到,锌棒多余的Zn+离子溶入溶液,而盐桥中的Cl-离子也溶入溶液与Zn+离子电中和;另一个半电池中也发生类似的反应,不同点是铜从溶液中析出,沉积在电极上。盐桥的作用是使两个半电池的电解质溶液互相隔离而又能相互导电。
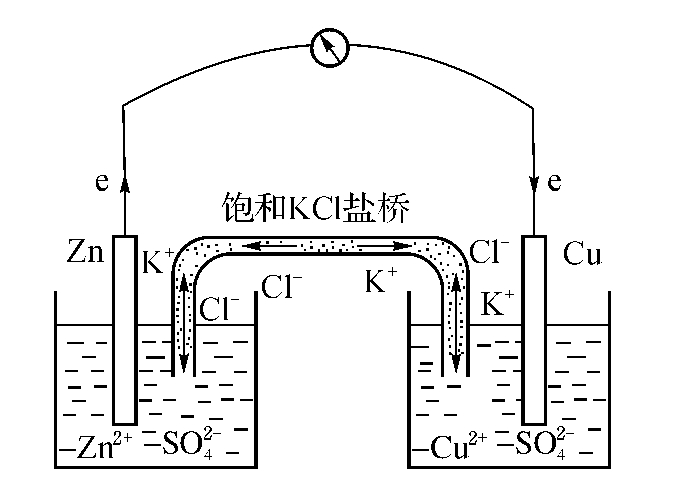
图11-2 锌铜原电池
电极电位可由能斯特方程计算。假设某电极反应为:
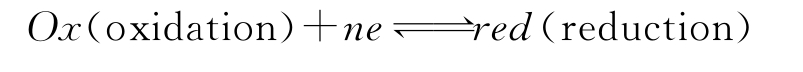
则相应的电极电位可由下列能斯特方程求得:
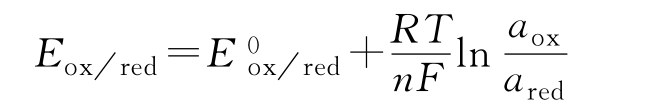
式中,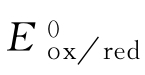 为标准电极电位,指标准温度(25℃)下,溶液中离子浓度为1mol/L时的电
为标准电极电位,指标准温度(25℃)下,溶液中离子浓度为1mol/L时的电
极电位,可视为一个常数项;R为气体常数,R=8.314(J·K-1·mol–1);T为绝对温度,T=273+℃(K);n为电子转移数;F为法拉第常数,F=96485(C/mol);aox为氧化态离子的活度;ared还原态离子的活度。对于固体、水、溶剂等,其氧化和还原态的浓度差别不大,如上例中金属电极的还原态是金属固体,此时,ared=1,上式可简写为:
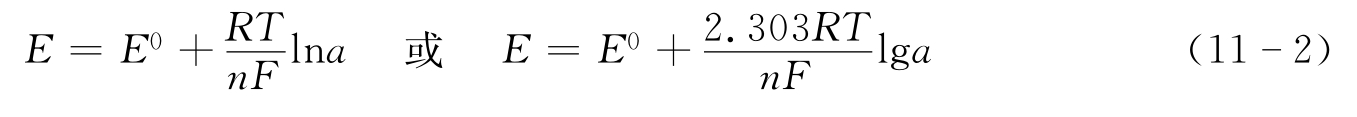
化学传感器是基于化学电池的原理,不同的是盐桥的作用由电化学薄膜(即敏感膜),如各种半透性薄膜和玻璃膜来完成;膜材料的分子结构只允许一种元素的原子或离子通过。可见,敏感膜除了隔离和导电的作用外,还具有离子选择性。单个电极的电位是不易测得的,实际测量时,每一个半电池构成一个电极,其中,对被测离子敏感的电极称为指示电极,即ISE;另一个电位不随待测溶液中被测离子浓度而改变的电极,称为参比电极(RE)。由参比电极和指示电极组成的测量系统如图11-3所示,它仍然是一个化学电池,可标记为:

其中“|”表示不同相物质的界面,不同相物质的接触面上存在相间电位。由上式及图11-3中可看出,敏感膜、内部溶液和内部电极三者构成了离子敏(选择)电极。式中:Er′为内部电极的电位;Em′为离子选择电极的外膜电位;Em为离子选择电极的内膜电位;Er为参比电极的电位;Ej为液接界电位,一般为零;Ea为膜内外表面的性质不对称引起的电位。
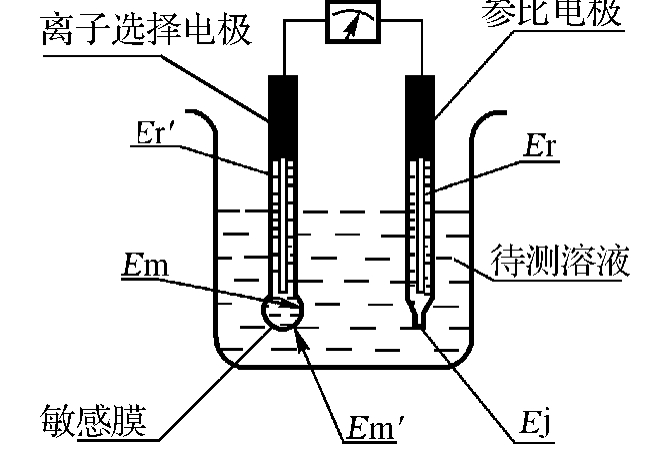
图11-3 ISE及其测量系统
该测量电池的电动势为
E=Er′+Em′+Em+Er+Ej+Ea
其中,只有膜外表面的电位由膜和待测溶液的性质决定,为被测量,其余均为常量,可归入能斯特方程中常量E0中。因此,测量两电极间的电势可获知被测溶液的浓度。
2.参比电极
理想参比电极的界面电势是固定不变的。一般要求参比电极电位不受待测溶液中离子浓度和温度变化的影响,重复性能好,湿度系数小。
常用参比电极有氢电极、甘汞电极、氯化银电极等。标准氢电极是一个精确的参比电极,其电极电位为零,由铂丝吸附氢并在规定条件下获得,制作和使用都十分复杂。因此,一般多用甘汞(Hg2Cl2)电极、氯化银(AgCl)电极。
(1)银—氯化银(Ag/AgCl)参比电极 在银丝外涂覆一层氯化银并浸在一定浓度的KCl溶液中可制成银—氯化银参比电极。其电极电位的电化学反应为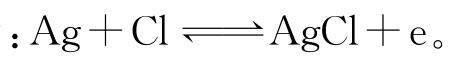 银—氯化银电极易受光照影响,要避光保存。另外,硫化物、碘化物可使电极中毒,溴化物对电极也有影响。
银—氯化银电极易受光照影响,要避光保存。另外,硫化物、碘化物可使电极中毒,溴化物对电极也有影响。
(2)甘汞电极(饱和甘汞电极) 将铂丝插入汞中,汞与Hg2Cl2、KCl接触可制成甘汞电极。应当注意,当温度高于70℃时产生下述平衡反应: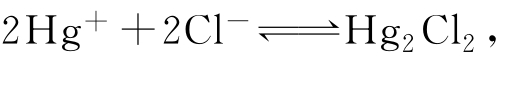 会导致电极电位不稳定。
会导致电极电位不稳定。
两种电极均已经标准化,其对标准氢电极的电极电位(NHE)如表11-1。
表11-1 25℃时,常用参比电极的电极电位(NHE)
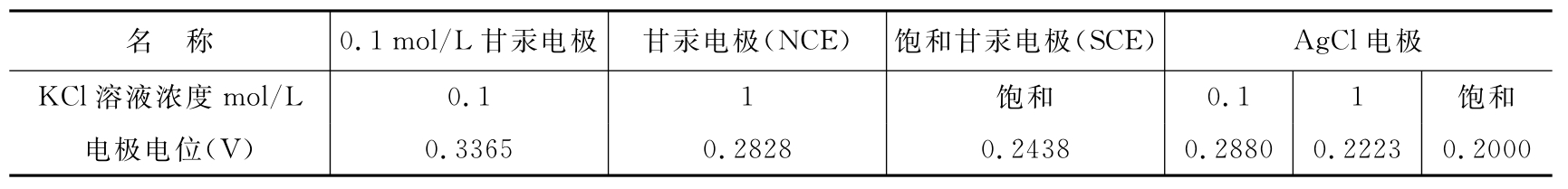
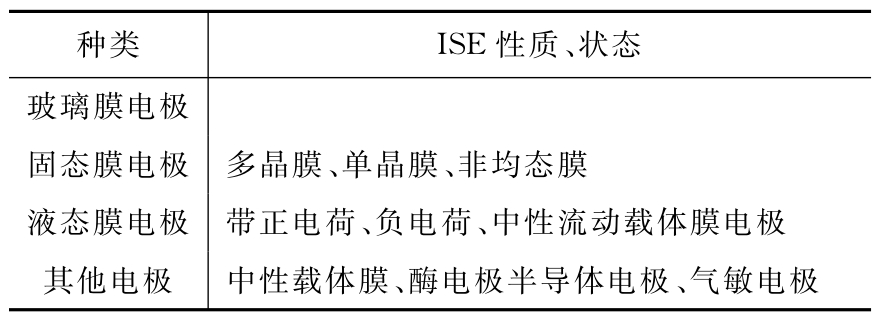
表11-2 离子选择电极
11.2.3 离子敏电极(ISE)
根据离子电极的物理状态、电化学活性物质的性质和敏感膜的结构,离子敏电极的种类如表11-2所示。其中常用的有玻璃膜电极和固态膜电极。
1.玻璃膜电极
图11-4 玻璃膜ISE结构示意图
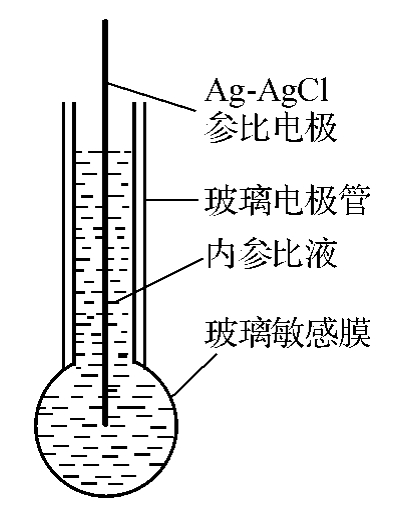
玻璃膜电极是对氢离子敏感的指示电极,主要成分为:SiO2、Na2O、CaO,结构如图11-4所示。玻璃膜把pH值不同的两种溶液隔开,膜电势的值由两边溶液的pH差值决定。如果固定一边溶液的pH值,则整个膜电势只随另一边溶液的pH值变化。因此,用它可以制成氢离子指示电极。在球形玻璃膜内放置pH值一定的缓冲溶液或0.1M的HCl溶液,并在溶液中浸入一支Ag-AgCl内部电极(实际上,内部电极的材料与结构,同参比电极一样)。当玻璃与水溶液接触时,玻璃表面会吸收水分,形成硅酸盐溶胀层(敏感膜)[2],其厚度约为0.05~1μm,而中间的干玻璃层厚度则约为50μm。由于玻璃相由SiO2骨架和骨架空隙中的Na+离子、Ca2+离子所构成,溶胀层中的钠离子可以与待测溶液中的氢离子交换,即溶液中的氢离子进入玻璃结构的空隙中,把一部分钠离子顶替出来;钙离子所带电荷多,静电作用强,不能被氢离子顶替出来。在玻璃膜与溶液的界面上不断发生氢离子与钠离子的交换作用达到平衡后,在玻璃膜的界面上产生了相对稳定的相间电势。参比电极(如甘汞电极)与玻璃膜电极一起插入待测溶液中组成原电池:
甘汞电极|待测溶液|玻璃薄膜|HCl(0.1M)|Ag,AgCl(S)
因此,玻璃膜的电势随着待测溶液中H+浓度而变,并对氢具有选择性。改变玻璃膜的配方,也可以制成对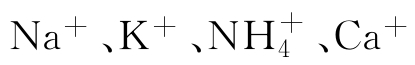 等一价离子敏感的离子敏电极。
等一价离子敏感的离子敏电极。
玻璃膜电极的特点是使用寿命长,稳定性高,输出阻抗在108Ω级,因此与之相应的毫伏表、酸度计等仪器的输入阻抗常达到1012Ω,玻璃膜电极的响应时间约30min。由于玻璃膜的化学稳定性较高,难与其他离子耦合,应用受到一定限制。
2.固态膜电极
用难溶盐制成单晶切片、多晶切片或混合物,代替玻璃膜,就可以制成各种负离子的选择性电极。如指示氯离子浓度的AgCl电极,指示S2-离子浓度的Ag2S电极和指示氟离子的浓度的LaF3电极等,它们的电极结构为:
内部溶液|Ag盐膜(AgX)|含X-待测溶液
这些难溶膜电极对难溶盐中的负离子敏感,是由于这些材料的晶体结构中存在晶格缺陷,允许离子在缺陷形成的空穴中自由移动形成离子导电,不同材料的晶格缺陷尺寸不同,对离子具有选择性。
固态膜电极的响应比玻璃膜快,能检测大多数负离子,但使用寿命有限,一般为几百次。
3.ISE的主要参数
(1)离子敏电极的选择性 一般待测溶液中常混有杂质,假如溶液除含有价数为ni的待测离子外,还含有价数为nj的干扰离子,则11-2式应改写为:
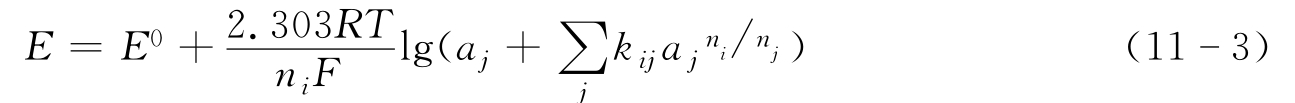
式中,kij为选择系数,它是离子选择电极对i离子的选择性与对j离子的选择性之比,一般应使kij<10-2,选择性很好的离子敏电极通常小于10-4。但是,有时这个数值也会非常大。如某型Na离子敏电极,kNa/H=30,说明这种电极虽然用于敏感钠离子,但对氢的敏感性是Na的30倍;而kNa/K<10-4,说明钾离子的存在不会影响检测结果。另外,选择系数不是一个常数,会受到温度、浓度影响,通常由实验测得。
(2)温度效应 能斯特方程中含有绝对温标T,因此,电极电位与温度有关,2.303RT/niF也称为能斯特斜率。温度测量误差常常是电极测量误差的主要因素之一,使用时应特别注意。
(3)响应时间 离子敏电极与测量溶液接触后,敏感膜需要一定时间与溶液离子交换达到电平衡,这段时间需要几分钟到几十分钟不等。
(4)迟滞特性 离子敏电极的响应时间与待测溶液的浓度有关,待测溶液浓度越高响应越快。离子电极检测高浓度溶液后如果立即检测低浓度溶液会产生较大的误差。这是因为检测浓溶液后离子电极需要一定的恢复时间,使用时应当遵循先低后高的顺序。
(5)pH范围 离子敏电极有一定的pH值适用范围,过高的酸性或碱性可能导致电极溶解或沉积,影响使用。一般应在弱酸或弱碱性溶液中使用。
(6)内阻或输出阻抗 离子电极的内阻为几欧至几百兆欧不等,环境温度也会影响电极
的内阻,使用时应使测量仪器输入阻抗与之匹配。
(7)电极寿命 一般用使用次数计,电极在不使用情况保存时间过长也会失效。
4.ISE测量方法
使用指示器(如离子计、毫伏表、酸度计)与离子敏电极组合成最常用的测量装置即图11-3所示。根据测量场合不同,如将指示器设计成专用电表,溶液池采用各种自动化装置,并以计算机控制和显示,可制成各种专用测量设备。
ISE的测量方法有直接电位法和滴定法两大类。直接电位法将参比电极和指示电极放入待测溶液中组成电池,根据能斯特方程直接测量电池的电位差来确定待测溶液中离子的种类和浓度。滴定法则要通过观察分析滴定过程中电池电位差的变化来确定滴定过程中溶液浓度的变化。
11.2.4 场效应管型离子敏传感器(ISFET)
ISFET实质上是将离子选择电极和场效应管(MOSFET)集成在一起。MOSFET的结构如图11-5所示,在P型硅衬底上扩散两个N+区用电极引出,分别作为源极S和漏极D。在源漏极区之间的P型硅表面生成SiO2绝缘层,再在源漏极之间的绝缘层上蒸镀一层金属铝作为栅极G。
在源漏极之间施加电压,而在栅极不加偏压时,栅极氧化层下面是P型硅,源漏极之间是N型硅,故源漏极之间不导通。当栅源之间有正向电压UGS时,会导致栅源极之间的电荷移动,并在栅极绝缘层下面的P型半导体材料的表面集聚负电荷,形成反型层。当UGS超过某一个阈值UT时,反型层将形成一个导电的N沟道。这时,若在源漏极之间施加电压USD,则源漏极之间形成漏电流ID,ID与UGS和USD的关系用图11-6所示的输出特性曲线表示。从图中可见,当UGS<UT时,MOSFET的导电沟道还未形成,故ID为零。当UGS>UT时,MOSFET开启,因此,UT又称开启电压。MOSFET的输出特性曲线可分为线性区、饱和区和雪崩区,其中线性区和饱和区为正常工作区。
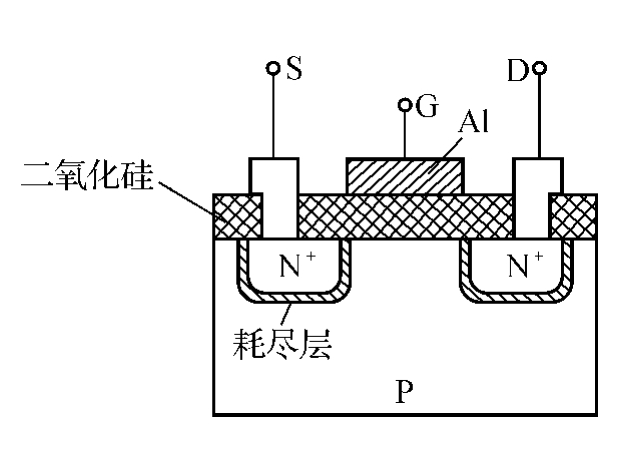
图11-5 MOSFET原理结构
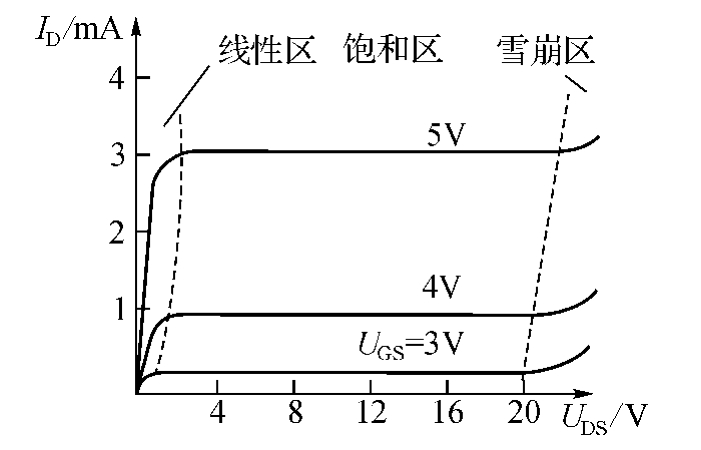
图11-6 MOSEFET输入输出特性
当UDS<UGS-UT,则MOSFET工作在线性区,又称放大区,ID随UDS的增大而增大,用β表示放大倍数,则
ID=β(UGS-UT-UDS/2)UDS (11-4)
当UDS>UGS-UT,则MOSFET工作在饱和区,此时,ID保持一定,而不能再随UDS的增大而变化:
ID=β(UGS-UT)2/2 (11-5)
由上述各式可看出,场效应管漏电流ID的大小与阈值电压UT有关。ISFET利用了这一特性,其结构原理如图11-7所示。将参比电极、待测溶液、敏感膜、MOSFET串联在栅
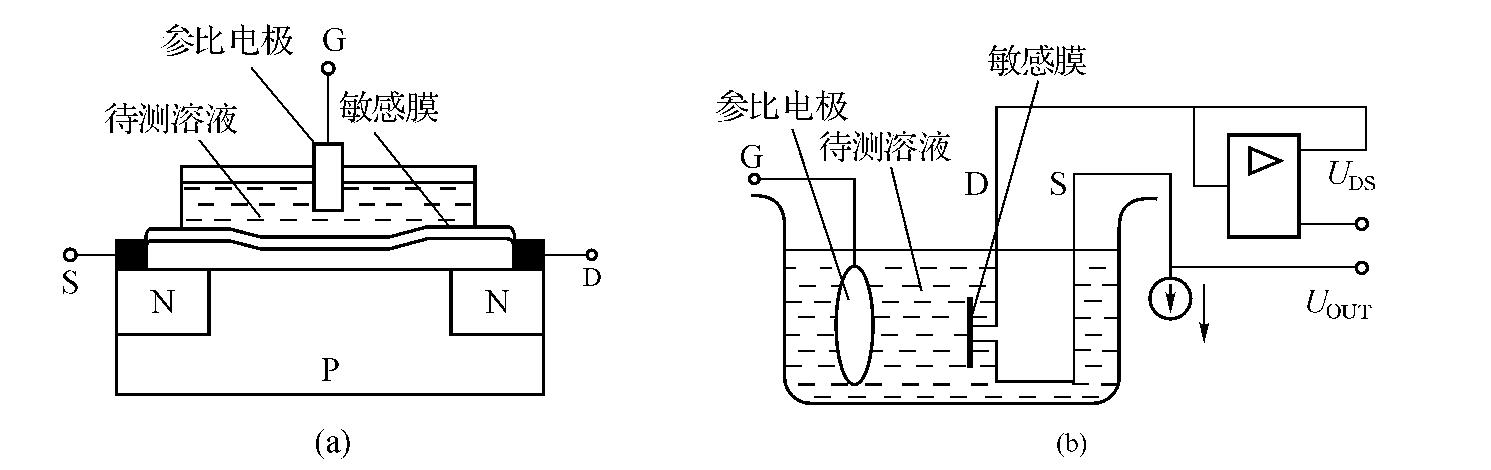
图11-7 离子敏场效应管原理
(a)ISFET结构;(b)外围共源电路
源回路中,构成外围共源电路。ISFET测量系统见图(b)。此时栅源电压为
U′GS=UGS-E-Er (11-6)
式中,E为敏感膜电势,Er为参比电极电势,则式(11-4)和式(11-5)分别变成
线性区: ID=β(UGS-E-Er-UT-UDS/2 )UDS
饱和区: ID=β(UGS-E-Er-UT)2/2
可见,如果固定UGS、UDS,则ID仅受U′T的影响,此式表明,ID的大小变化反映了被测溶液中离子活度的变化。
ISFET用于电解质溶液的测量时,为了防止漏电,其源极、漏极必须良好绝缘封装。常规封装结构为扁平式,如图11-8所示。用引线把芯片与管脚接通,除敏感栅外,其余用环氧树脂覆盖,然后把带有管芯的陶瓷支架用环氧树脂固定密封在内径适当的塑料管或玻璃管中。医用封装要求外形尺寸小,并能消毒。多功能封装结构将多种敏感膜做在同一个基底上,制成多功能ISFET,可以测量多种离子。
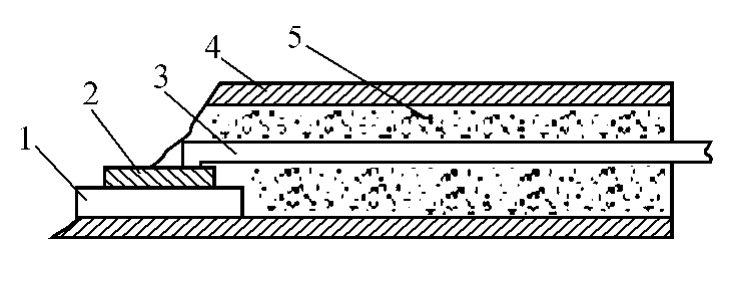
图11-8 ISFET封装结构
1—陶瓷支架;2—敏感栅;3-引线;4—塑料管;5—环氧树脂
ISFET有以下特点:
(1)输出阻抗低。一般ISE的输出阻抗很高,可达兆欧级,而ISFET却具有MOSFET输入阻抗高、输出阻抗很低的特点。同时还具有放大作用。
(2)全固态化结构,体积小,重量轻、机械强度高。
(3)由于利用了成熟的半导体制造技术,其敏感膜可以做得很薄,一般不到1000埃,因此膜的水化时间很短,响应很快,一般不到1s。
11.2.5 离子敏传感器的应用
1.用滴定法测量甲醛含量
根据甲醛与亚硫酸钠反应生成甲醛化的亚硫酸钠和当量的氢氧化钠(H2O+HCHO+Na2SO3→NaHO+HO—CH2NaSO3),利用pH复合电极(氢离子敏电极)来测量pH值,从而直接测定甲醛含量。取已稀释1000倍的甲醛标液25ml和25ml浓度为1mol/L的Na2SO3,在烧杯中混合,插入pH复合电极,用0.0424mol/L的标准HCl溶液滴定,每0.5ml记录一次,数据如下:
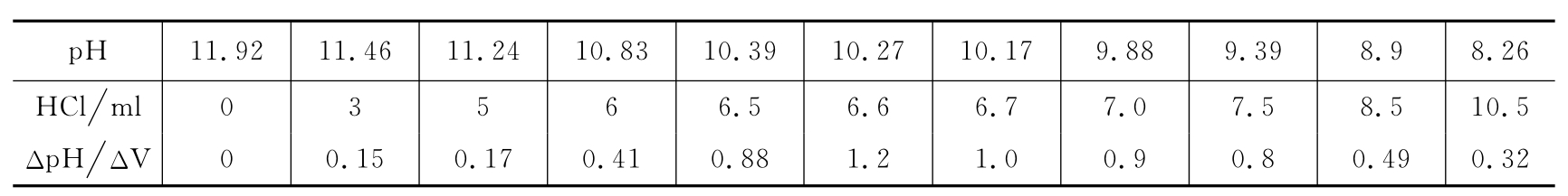
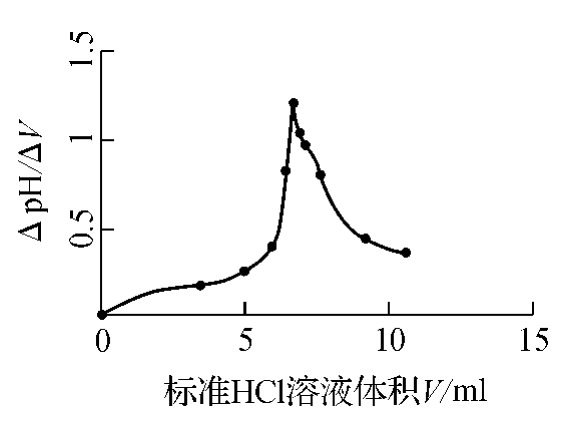
图11-9 ΔpH/ΔV曲线
根据上表作出pH值对滴定剂体积微分ΔpH/ΔV曲线如图11-9,其中最高点表示pH值发生突变或阶跃,表明反应物中HCl已经过量。因此,这点是滴定终点,称为等当电势点。根据所消耗的HCl可以计算出甲醛含量。与直接电位法相比,滴定法有较高的精确度,但耗时较多。
2.微库仑仪
图11-10为微库仑仪原理图,参考电极和测量电极间的电压V表征了池中的滴定离子浓度。图中开关按照固定的频率切换,当拨到图中实线位置时,称为测量周期;当开关拨到虚线位置时,称为电解周期。它的工作过程是:
(1)在样品注入滴定池前,参考电极到测量电极间的电压为V0。设置偏压,使之为-V0。测量周期中,采样电容采样到电压为值Vc=V0。紧接着的电解周期中,采样电容和偏压串联接入库仑放大器,这时由于偏压在之前已经设为-V0,因此库仑放大器输入为Vc-V0=0,输出也为0,积分仪没有显示,电解电极上也不会有电压。
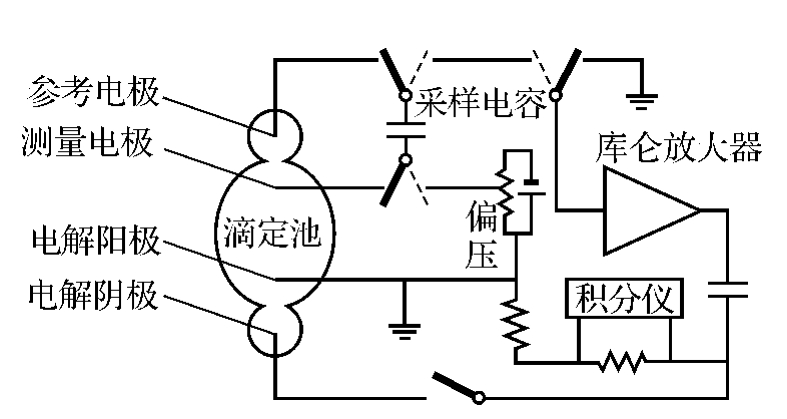
图11-10 微库仑仪原理
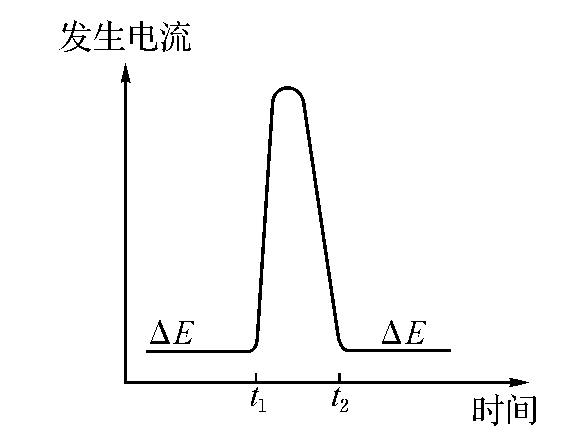
图11-11 微库仑仪电流-时间曲线
(2)样品注入滴定池后,由于滴定离子和样品发生了反应,使极间电压V发生了变化。这时库仑放大器的输入不为0,它的输出被加到电解电极上;这一过程持续进行,直到电解生成的滴定离子补充了消耗掉的滴定离子,使得电压值又回到了初始值V0。这个过程中,记录下电解电流的变化曲线如图11-11所示。这个曲线的积分值也就是反应消耗的电量,其单位是库仑。库仑值同样品中离子的含量成正比,因此可根据消耗的电量推算出样品中待测离子的含量。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















