DNA介导所转移的基因在受体细胞中的表达往往是不稳定的。斯坎加斯(G.Scangas)和赫特纳(K.Huttner)等对外源DNA在受体细胞中的结构及其稳定性做了系统的研究。
体外培养的哺乳动物细胞的DNA转化实验需要三个组分:供体DNA、缓冲培养基和带有遗传学标记的受体细胞。若要提高转化效率,就要使转化的标志基因和大分子DNA载体结合以增大供体DNA的分子量,同时还必须使用刚培养的新鲜受体细胞。转化后得到的受体细胞可以有一个或多个外源DNA拷贝,但在受体细胞的分裂过程中,有些DNA片段会随机丢失。在稳定的转化细胞(transformed cell)形成之前,转移基因先和大分子的载体DNA组成一个分子量介于50~170 kb的转移基因组(transgenome)。在分裂过程中,转移基因组仍有丢失的可能,只有当转移基因组整合于受体细胞的染色体后,才会形成稳定的转化细胞。不同的转化细胞克隆具有各自偏好或倾向的整合位置。还有人发现,当多个拷贝的外源DNA被导入细胞后,会随机地聚集在寄主细胞基因组的一个或很少几个位点,并通过哺乳动物体细胞内能有效介导同源重组的酶系统将多个外源DNA组成首尾相连的多聚体(head-to-tail concatemer),这或许会使外源DNA整合于染色体的概率有所增加(图6-14)。
在DNA介导的基因转移中起决定作用的技术因素还是选择。如果没有一个能在数以亿计的受体细胞中,识别和选择转化细胞的选择系统,是难以进行转化实验研究的。这势必会限制许多找不到适当的选择系统,而又有重要生物学意义的基因的转化研究。20世纪80年代中期,有人开始探索非选择性标记和选择性标记一起转移的可能性。研究表明,如果将非选择性标志基因用量加大,使它和选择性标志基因的比例达到102~104,那么两者同时转移的机会可提高50%~80%。选择性标记和非选择性标记共同转移的现象称为共转移(co-transfer)或并发转化(cotransformation)。共转移技术为分离、转化和研究数目众多的非选择性基因创造了实验前提。1983年,拉布丹-孔布(C.Rabourdin-Combe)和马赫(B.Mach)采用共转移技术成功转移并在受体细胞中获得表达了大鼠细胞表面抗原HLA-DR,这为并发转化中的非选择性基因在受体细胞中表达提供了有价值的实例。在第8章要讨论的癌基因转化实验中也要广泛应用基因共转移技术。
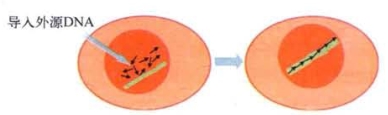
图6-14 多个拷贝的外源DNA(黑色箭头所示)在体细胞核内整合过程示意(改自M.R.Capecchi等)
总起来看,DNA介导的基因转移是一个多阶段过程。外源DNA进入受体细胞后先部分降解,有些DNA分子会借助细胞内源性同源重组酶连接成有一定方向的大分子,再和大分子载体DNA相连而形成一个能接受调控并能表达的转移基因组,最后整合于受体细胞的染色体成为细胞基因组的新组分。这时的受体细胞才会成为具有稳定的基因型和表型的转化细胞。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















