由于熵是状态函数,其变化与过程无关。因此,可用一特殊过程来讨论系统的熵变问题。
设系统由N个理想气体分子组成,当它由状态1(T,V1)等温地变化到状态2(T,V2)时,其相应的微观态数目由Ω1变化到Ω2。于是,系统在该过程中的熵变为
将V划分为n个体积为V=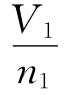 的小格,则每个分子的微观态数目便与格子110数n1相同,即Ω1i=n1,这时,系统总的微观态数目为
的小格,则每个分子的微观态数目便与格子110数n1相同,即Ω1i=n1,这时,系统总的微观态数目为
同法可得,对于体积为V2的系统的微观态数目为
以式(11-5-6)除式(11-5-7),得
![]()
将式(11-5-8)代入式(11-5-5),得
![]()
![]()
由式(11-2-6)可知 代表系统在等温(可逆)过程中吸收的热量Q,将Q代入上式,得
代表系统在等温(可逆)过程中吸收的热量Q,将Q代入上式,得
将上式应用于一微小过程,得
式中,dQ代表系统在任意微小的可逆(等温)过程中吸收的热量。
由热力学第一定律有,dQ=dU+pdV,则上式又可写为
式(11-5-10)、式(11-5-11)、式(11-5-12)是计算热力学过程中熵变化的基本公式,式中T、p、V均为状态参量。
如果系统是孤立或绝热的,则dQ=0,将其代入式(11-5-11),得
将式(11-5-4)与式(11-5-13)结合起来,得
式中,不等号对应于不可逆过程,等号对应于可逆过程。式(11-5-14)表明,当孤立(或绝热)系统内部所发生的过程不可逆时,其熵增加;所发生的过程可逆时,其熵不变。也就是说,孤立(或绝热)系统的熵只能增加,不能减少。这一结论称为熵增加原理。
应当注意,熵增加原理中所说的熵增加是对整个系统来说的,至于系统中的个别物体,其熵既可增加,也可减少。
熵增加原理指出,在孤立(或绝热)系统中,不可逆过程总是自发地向熵增加的方向进行,因而可通过比较过程中两个不同状态的熵值来判别过程的方向:由熵值小的态指向熵值大的态。这与热力学第二定律的统计意义完全一致。
当系统达到平衡时,其熵不再增大而达到极大。所以对于孤立系统内的各种可能状态而言,平衡态的熵最大。这一规律称为热平衡的熵判据。因此,也可以将熵看成是孤立(或绝热)系统接近平衡态的量度:熵值越大,表示系统越接近平衡态。
【例11-7】 设1kg的水在标准状态下的熵为零,假设气压不变。已知水的比热容c=4.18J/(g·K),汽化热为ΔvapHm=2 253J/(g·K),凝固热为Δfush=334.4J/(g·K)。
(1)水的温度升为100℃时,熵是多少?
(2)水全部变为100℃的蒸汽时,熵是多少?
(3)水全部变为0℃的冰时,熵是多少?
(4)水由0℃的冰变为100℃的蒸汽时,熵的改变是多少?
解 标准状态下,温度为273K,压强为1.013×105 Pa。
(1)T1=273K的水等压升温到T2=373K是不可逆过程。若控制外界热源的温度,使水无限缓慢地升温,就构成一个可逆过程,对此可逆过程,有
因为规定S1=0,所以
(2)用稍高于100℃的热源,无限缓慢地给100℃的水加热,使之变为蒸汽,这样就构成了一个可逆等温过程,于是
因为规定S1=0,所以
(3)用稍低于0℃的热源,无限缓慢地从0℃的水吸热,使之变成冰,这样就构成了一个可逆等温过程,于是
因为规定S1=0,所以
![]()
(4)由0℃下的冰变为100℃的蒸汽,熵的改变为
【例11-8】 8g氧气从状态1(V1=0.1m3,T1=353K)过渡到状态2(V2=0.4m3,T2=573K),求熵变。设氧气可视为理想气体。
解 由于熵是状态函数,如果能求出熵变的状态函数表达式,代入初态和末态的数据也可求出熵变。
氧气为双原子分子,摩尔定容热容C,= ,先求出熵变的状态函数表达式:Vm
,先求出熵变的状态函数表达式:Vm
由热力学第一定律,有
![]()
由理想气体状态方程可得
因而可得
![]()
代入数据,得
![]()
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















