(一)电泳检测
在用层析技术纯化蛋白质的过程中,我们通常采用电泳技术来跟踪蛋白的“行迹”。这里主要介绍SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)和等电聚焦电泳(IEF)。
SDS-PAGE是根据蛋白质的分子量差异而将蛋白质纯化的一种技术,它是从“移动界面电泳”的基础上发展而来,具有两大特点:①该凝胶可通过调节聚集单体和交联剂的比例而控制小孔的大小,以满足不同分子量大小颗粒的分离需要;②所有蛋白质都被SDS完全变性,呈伸展状态,具有相似的质核比。电泳结束后的凝胶经考马斯亮蓝染色或银染之后,每条蛋白带的近似分子量可以在已知分子量的标准品的指示下很快获得。
IEF电泳是根据蛋白质的等电点差异而将蛋白质分离纯化的。等电点(pI)是每一种蛋白质都具有的一个特征性参数。每一个蛋白质分子,只要不是处于一个pH与其等电点相等的环境中时,一般总是带有一定的净电荷。因此,蛋白质分子可以被看做是带电颗粒,在外加电场中将向与其带电符号相反的电极移动。当蛋白质所在溶液的pH正好等于其pI值时,该蛋白质所带正电荷和负电荷正好相等,蛋白质所带净电荷为零,这种状态下的蛋白质分子在外加电场中是不会移动的。IEF电泳的工作原理即是:通过预电泳使加在凝胶柱中的两性电解质混合物中的每一个分子往一定的方向移动,最后带负电荷和正电荷最多的两性电解质分别集中在凝胶柱的两端,中间形成一个连续的pH梯度带,而后加入样品蛋白,在电场作用下,带电的样品蛋白将在pH梯度中移动,进入与其pI相等的pH区域后该蛋白质分子的净电荷为零,从而停止移动而停留在那里。通过计算样品蛋白所驻留区的pH即可知道样品蛋白的pI值。
以上所述的两种电泳,前者无法分开分子量差异不大的蛋白质,而后者无法分开等电点差异不大的蛋白质,所以通常将两者结合起来构成所谓的二维凝胶电泳,即电泳分两步进行。首先用凝胶柱将保持天然构象的混合蛋白通过等电聚焦电泳进行分离(第一维)。然后再将凝胶柱中带有经过等电聚焦分离好的蛋白样品的凝胶取出,并横向地放置在一聚丙烯酰胺凝胶的上样端进行SDS-PAGE分离(第二维)。二维产生的一个个点就代表着性质不同的蛋白质。如果是某一个点中含有两种蛋白质的话,就表明这两个蛋白必须是分子量和等电点都相同。然而,目前的二维电泳技术还有不少缺陷,具有以下特征的蛋白在二维电泳中还很难被检测到:①等电点值很大或很小的,比如大于8或小于4的蛋白质;②分子量很大的蛋白质;③疏水性蛋白质(图6-7)。
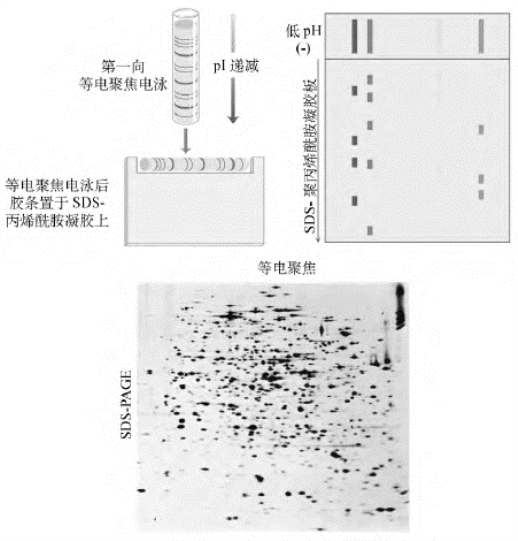
图6-7 SDS-PAGE、IEF
(二)测定纯化蛋白质的分子大小
测定蛋白处于非变性条件下的大小一般可通过以下几种方法(图6-8)。
1.排阻层析 其原理前已叙述,此处不再谈及。测定蛋白质分子大小的时候,要选择好所用树脂的孔径范围、标准蛋白的大小分布。其优点是简单易行;缺点是分辨效果不是很高,只能得到一个比较粗的蛋白质分子质量的数值。
2.沉降平衡超速离心 这是一种比排阻层析更为有效的、测定非变性条件下蛋白质分子大小的方法,它是分析超速离心技术中的一种。其测定的是几个绝对动力学参数,因此被广泛地用于测定小到蔗糖大到病毒的不同样品的大小。
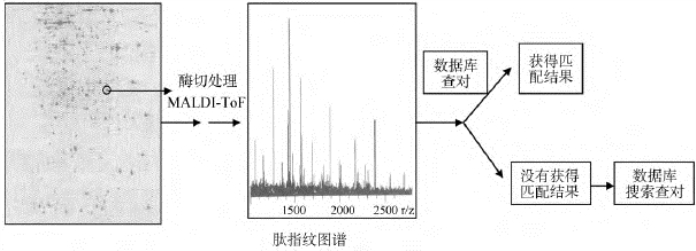
图6-8 蛋白质鉴定的一般方法
沉降平衡超速离心的原理是:当蛋白样品在相对较低的离心速度下离心时,在一个从离心管顶部指向底部的、越往底部越大的沉降力的作用下,蛋白质分子很快形成一个从离心管顶部往下逐渐增加的连续蛋白质浓度梯度;与此同时,将有一个方向与离心力相反的扩散力作用于蛋白分子上;当沉降离心进行一定时间后,作用于蛋白分子上的离心力和扩散力正好相互消除,这样使得蛋白样品的表面处于一个平衡状态而不再移动;在这种平衡条件下,不同部位蛋白浓度与所在部位离轴心的距离之间的关系与蛋白质分子质量成某种数学关系。正是通过这种关系我们可以测定蛋白质分子的质量。进行这种分析所用的超速离心机都配有特殊的光学系统装置,可以通过扫描连续观察离心管中不同部位的蛋白浓度。当蛋白质分子在离心力和扩散力作用下所形成的浓度梯度不随时间变化时,说明离心的平衡点到达了。这时,测定离心管中离轴心不同距离处的蛋白浓度,然后所获得的数据通过计算机进行数学处理即可获得蛋白质的分子质量。
3.动态弹性光散射 通过测定蛋白颗粒的直径,然后与标准蛋白样品比较而推算蛋白分子质量。该技术也可通过观察样品是单分散性还是多分散性来反映所测蛋白样品是否均一。
4.孔径梯度电泳 通过制备具有一定范围的从大到小孔径梯度的聚丙烯酰胺凝胶,然后让蛋白在非变性条件下的凝胶中进行电泳。经过低电流条件下的较长时间的电泳,蛋白质分子将在凝胶中与其直径相等的孔径处停下。通过与同时在凝胶中电泳的标准样品比较我们可以知道蛋白在这种非变性条件下的质量。与沉降超速离心分析类似,这种方法获得的是天然状态下的蛋白质分子大小。如果蛋白分子能够在这种低电流电场中长时间保持稳定的话,这种方法比沉降平衡超速离心所需的昂贵设备来说更经济实惠。
5.质谱 这是一种在化学中被广泛采用的、测定原子或分子质量的方法中最直接、最准确的方法。原理:首先纯化好的蛋白样品要被转变成挥发和带电(即解离)状态,这一般通过电喷雾电离(electropray ionization,ESI)或基质辅助激光解吸电离(matrix-assisted laser desorption ionization,MALDI)两种方法实现。电离后的蛋白质分子然后进入一个真空加速电场中,之后,不同质荷比的蛋白质分子表现出的行为[或者在外加磁场中偏转,或者抵达固定探测器的所谓“飞行时间(time of flight,TOF)”]不一样。利用所测得的质荷比以及蛋白所带的电荷值,计算机软件很快就会正确地给出所测蛋白分子的质量。
首先对目的蛋白质样品进行2D电泳,然后扫描分析电泳结果,酶解处理蛋白斑点;采用MALDI-ToF(Matrix-assisted laser desorption/ionization by time-of flight),对质谱结果(形象地称之肽指纹谱图,PMF)在相应数据库中搜索寻找匹配对象,如果结果不明确,则可以利用LC/MS/MS技术(液相质谱结合串联质谱)继续分析鉴定。
用质谱测定蛋白质的分子质量,可精确达0.01%,是目前进行蛋白质分子量测定最准确的方法。
(三)测定蛋白质的氨基酸序列
在蛋白质被纯化出来之后,用自动氨基酸测序仪测定其部分或全部的氨基酸序列(见第三节详述)。
(四)用抗体探测特异蛋白质分子
目前,应用抗体研究蛋白质的方法主要包括以下几种。
1.蛋白质印迹(Western blotting) 是一种被广泛使用的蛋白质检测法。此法与研究核酸时用的印迹法原理非常类似,只是蛋白质印迹法最后是利用抗原-抗体之间的特异结合反应而检测的,而核酸类的印迹法是利用核酸分子之间通过特异碱基配对法从而形成杂交分子这一原理而检测的。在应用蛋白质印迹检测时,蛋白质混合物通过电泳被分开,蛋白质被转移到一种特别的膜上,然后让特异的抗体与固定在膜上的特异抗原蛋白结合。抗原-抗体之间结合的高度特异性使得用某种蛋白质分子制备的特异抗体分子只与膜上的这种蛋白质分子结合,而不与膜上存在的成千上万的其他蛋白质发生相互作用。结合了特异抗体的蛋白质条带可以通过能与结合在抗原蛋白上的所谓“第一”抗体结合的、被一种特异的酶/化学发光基团/荧光基团/放射性核素标记的“第二”抗体进行显示。这样我们可以知道与特异性抗体对应的抗原蛋白在检测的蛋白质混合物中是否存在?相对量多少?如果蛋白混合物是通过SDS-PAGE分开的话,被检测蛋白的分子量也就一目了然(图6-9)。
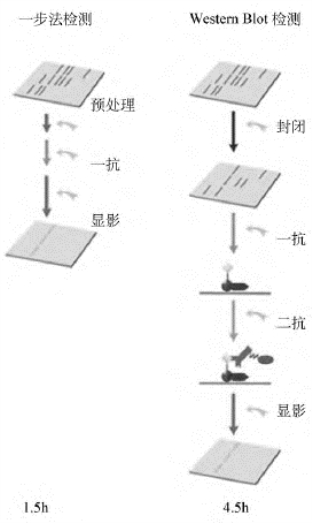
图6-9 Western Blot操作要点
2.免疫共沉淀 免疫共沉淀(coimmunoprecipitation)是一种在体外探测两个蛋白分子之间是否存在特异相互作用的方法。原理:如果两个蛋白在体外系统中能够发生特异相互作用的话,那么当用两个蛋白中的一个所对应的抗体进行免疫沉淀的时候,另一个蛋白也将同时被沉淀下来。但是,在很多情况下,两个蛋白在体内能够发生特异相互作用,在体外系统中可能测不到这种相互作用。原因可能在于体外系统中蛋白存在的浓度与体内相比要低多了,另外,体外使用的缓冲溶液系统与体内的环境也有很大差异(图6-10)。
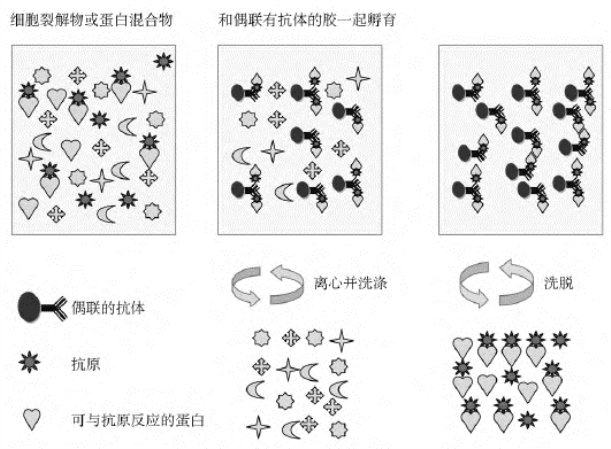
图6-10 免疫共沉淀技术原理
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














