任务1 动物细胞培养技术的内涵与应用
一、细胞培养的基本概念
细胞培养是一种体外培养技术,细胞培养和传统的组织培养既有区别又有联系。
体外培养(in vitro culture)是指从生物体活体内取出组织(多指组织块),在模拟体内特定的生理环境等条件下,进行培养,使之生存并生长。体外培养可分为细胞培养、组织培养和器官培养。
(1)细胞培养(cell culture)是指细胞(包括单个细胞)在体外条件下的生长。动物细胞培养(animal cell culture)是指将从动物活体内取出的组织用机械或消化的方法分散成单细胞悬液,然后模拟体内环境,进行培养,使其生存、生长并维持其结构与功能的技术。动物细胞培养的对象为单个细胞或细胞群,细胞不再形成组织,但在实际工作中,常将它扩展至组织培养与器官培养。
(2)组织培养(tissue culture)的本意是指从体内取出组织和细胞,模拟体内生理环境,在无菌、适当温度和一定营养条件下,使之生存和生长并维持其结构和功能的技术。但在培养组织的过程中,现代的培养技术尚不能在体外维持组织的结构和机能长期不变,生存环境的改变、培养时间过长,特别是反复传代,都很容易导致细胞发生变化或出现单一化现象,即趋向于变成单一类型细胞,最终便也成了细胞培养。
(3)器官培养(organ culture)的对象是器官的原基、器官的一部分或整个器官(一般是胚胎器官),应用和组织培养相似的条件,使之在体外生存、生长并保持一定的结构和功能特征的技术。器官培养的对象在体外也可能发生一定程度的分化,但始终保持着器官的基本结构和功能特征。
体外培养过程如图1-1所示。
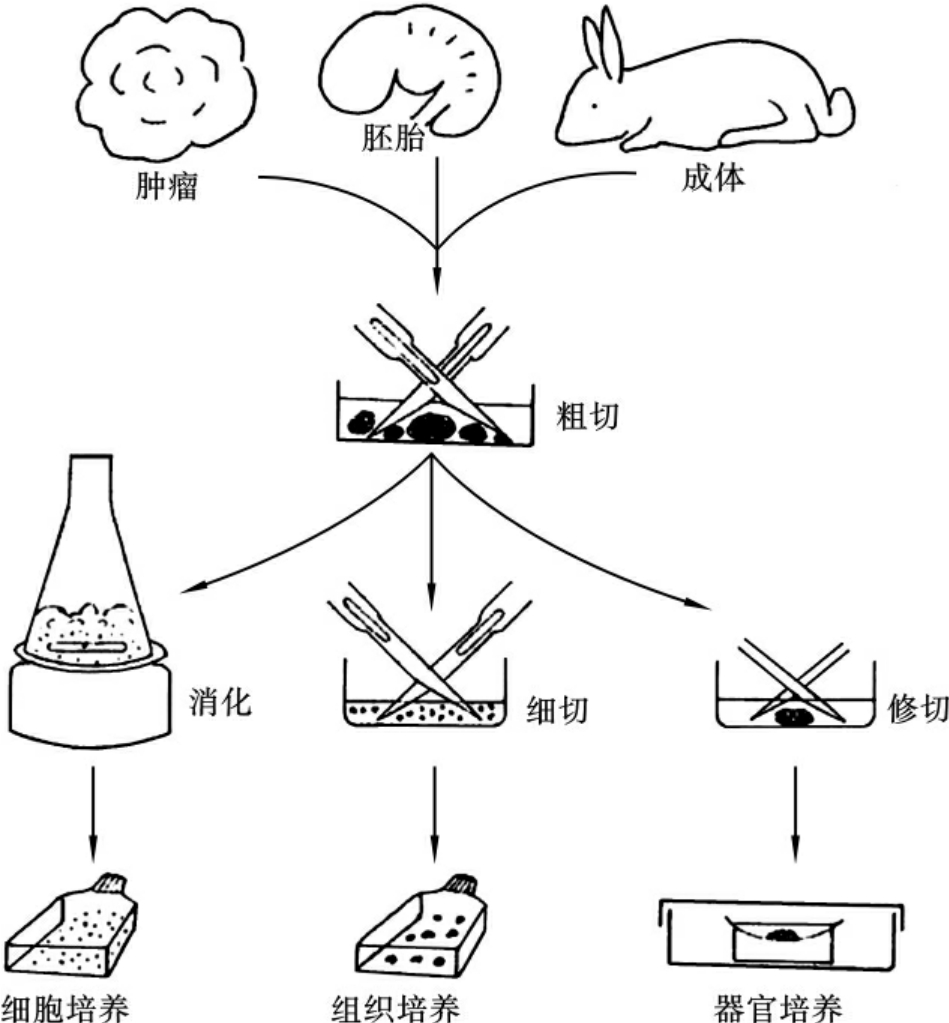
图1-1 体外培养过程
二、动物细胞培养的发展史
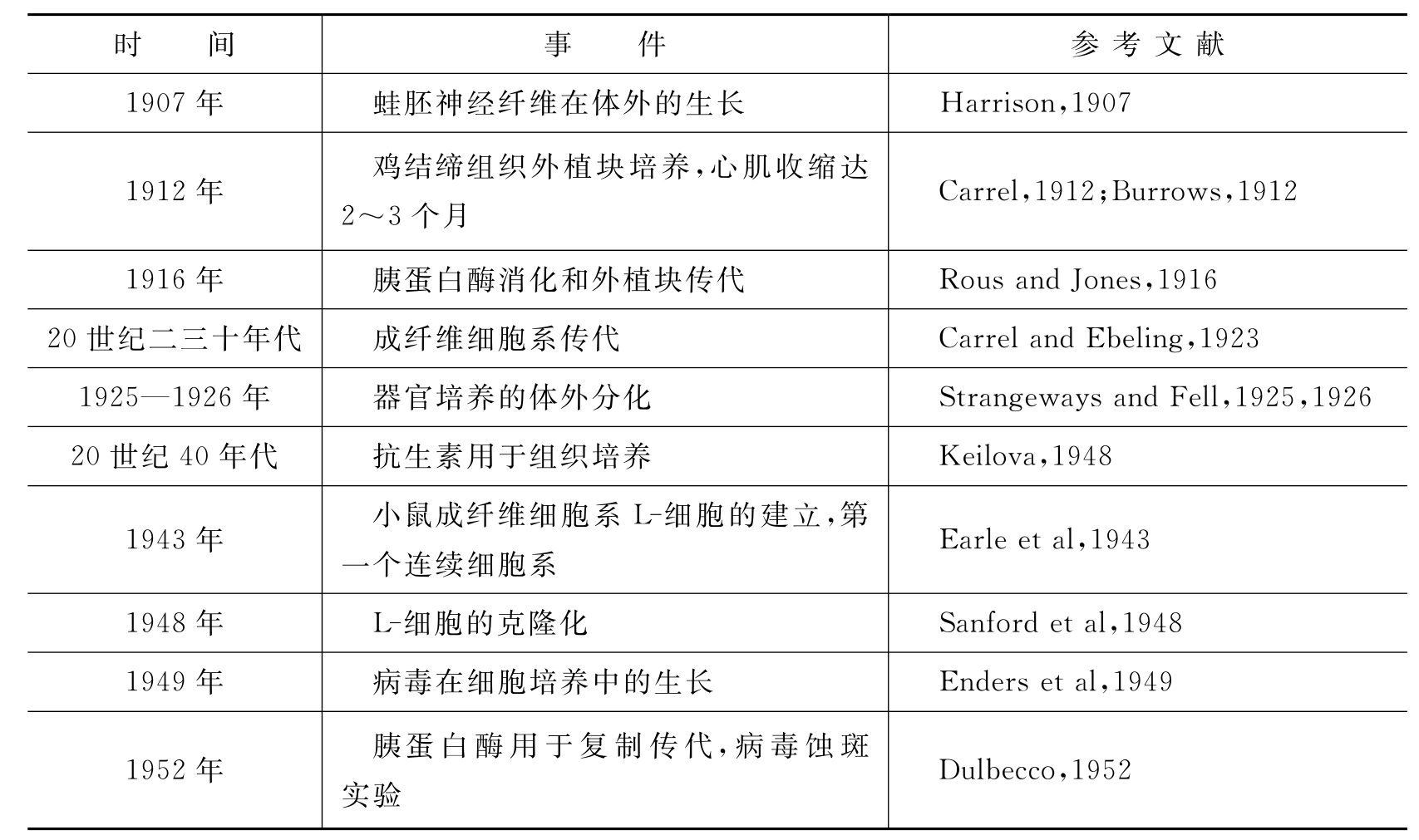
细胞培养技术的发展经历了百余年的时间,现已广泛应用于生物学和医学等研究领域。1885年,德国人W.Roux用温热的生理盐水在体外培养鸡胚髓板,使之存活了数天,第一次取得组织块人工培养的成功,并首次采用了“tissue culture”这个词组,被认为是组织培养的萌芽实验。1906年,Beebe和Ewing用盖玻片悬滴培养法,以动物血清做培养基,培养狗淋巴细胞,使之存活了72h,并观察到了细胞生长现象。
现代细胞培养是从R.Harrison和A.Carrel两人开始的。1907年,Harrison参考前人的经验,创建了盖玻片覆盖凹窝玻璃悬滴培养法(图1-2)。此法的基本技术是在无菌条件下,将蛙胚髓管部的小片神经组织接种于一加有蛙淋巴液的盖玻片上,然后翻转盖玻片,使组织小片和淋巴液悬挂在盖玻片的表面,再将这块盖玻片密封在一个下凹的载玻板之上。通过这种技术,在体外培养存活了数周,并观察到了神经细胞突起的生长过程,建立了体外培养组织和细胞的基本模式系统,Harrison被称为动物细胞培养的奠基人。
Carrel在进一步改进组织培养技术方面也作出了很大贡献,他把严格的外科无菌操作引进到组织培养技术中来。1912年,Carrel用血浆包埋组织块外加胎汁的培养法,并采用了更新培养基和分离组织的传代措施,在没有抗生素的情况下,培养鸡胚心肌组织长达数年之久。他指出,用反复传代的方法使细胞系存活三四年之久是可行的。1923年,他又设计了卡氏培养瓶(Carrel flask)(图1-3)。使用这种瓶容易避免组织的偶然性污染,扩大组织的生存空间,同时也能简化许多维持长期培养所需的操作。卡氏培养瓶至今仍被实验室采用。
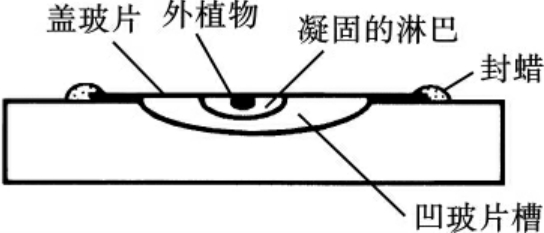
图1-2 Harrison悬滴培养法
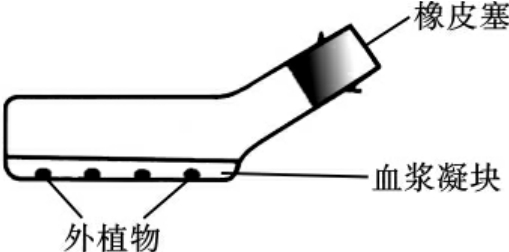
图1-3 卡氏培养瓶
从20世纪50年代起,细胞培养开始进入迅速发展的阶段。相继有很多学者从改进培养操作方法、培养容器和培养基三个方面,进行了很多革新。在卡氏培养瓶设计原理的启示下,相继出现了各种类型的培养瓶、培养皿、试管、多孔培养板。培养基也由天然动物血浆改进为人工合成培养基,促细胞生长物质也由胎汁改进为动物血清。与此同时,培养操作方法的革新也非常迅速。1952—1957年,Sanford和Dulbecco等人采用胰蛋白酶消化处理和应用液体培养基的方法,建立了单层细胞培养技术,此后单层细胞培养技术便成为组织培养普遍应用的技术,并建立了许多细胞系和细胞株,大大促进了组织培养技术的发展。1952年,Gey等建立了第一个连续的人细胞系,即HeLa细胞系;随着X射线照射的饲养层概念被引入克隆技术,1955年Puck克隆了HeLa细胞。20世纪50年代也是化学合成培养基快速发展的年代,并最终导致无血清培养基的问世。
20世纪50年代末,随着生物科学和技术的相互渗透,遗传学和生物化学的相互结续表合,出现了分子遗传学、分子生物学、细胞工程等新兴科学,这些新科学的形成和发展都与细胞培养有着密切关系。
1962年,Okata发现仙台病毒(Sendal virus)可诱发艾氏腹水瘤细胞融合形成多核细胞,为动物细胞融合技术的发展奠定了基础。1975年,诺贝尔医学和生理学奖获得者Cesar Milstein和Geoger Kohler将免疫小鼠的脾细胞和小鼠骨髓瘤细胞进行融合,获得了既能在体外无限繁殖,又能产生特异性抗体的杂交瘤细胞,有力地促进了免疫学的发展。
细胞培养技术发展迅速,试管植物、试管动物、转基因生物反应器等相继问世。以色列科学家用胚胎干细胞培养出人类心脏组织,它可以正常跳动;美国科学家培养出造血先驱细胞,中国科学家培养出胃和肠黏膜组织等。1977年,英国科学家利用胚胎工程技术成功地培养出世界首例试管婴儿;1997年,英国科学家首次克隆出绵羊“多利”;2001年,英国科学家又培育出首批转基因猪。
早在20世纪30年代,细胞培养技术就已传入我国。张钧、鲍鉴清曾分别在上海和北平倡导过细胞培养方法,并进行了一些实验工作。1952年,鲍鉴清在天津建立了组织培养实验室并编写了《组织培养技术》,之后,北京、上海、武汉、长春等地也相继建立了一些用于研究或制备生物制品的细胞培养室。20世纪60年代细胞培养技术有了进一步的发展。20世纪70年代后,细胞培养技术在我国已不再是个别实验室所拥有的技术,而成为医学和生物学研究中普遍应用的手段。近二十年来我国已建立了人和各种动物肿瘤及其他细胞系。细胞培养技术已被广泛用于生物学和医学研究的各个领域,包括用各种理化措施诱发遗传欠缺细胞株、应用细胞杂交瘤技术制备单克隆抗体、用培养细胞检测环境中可疑致癌物质、癌基因转染和细胞转化等。
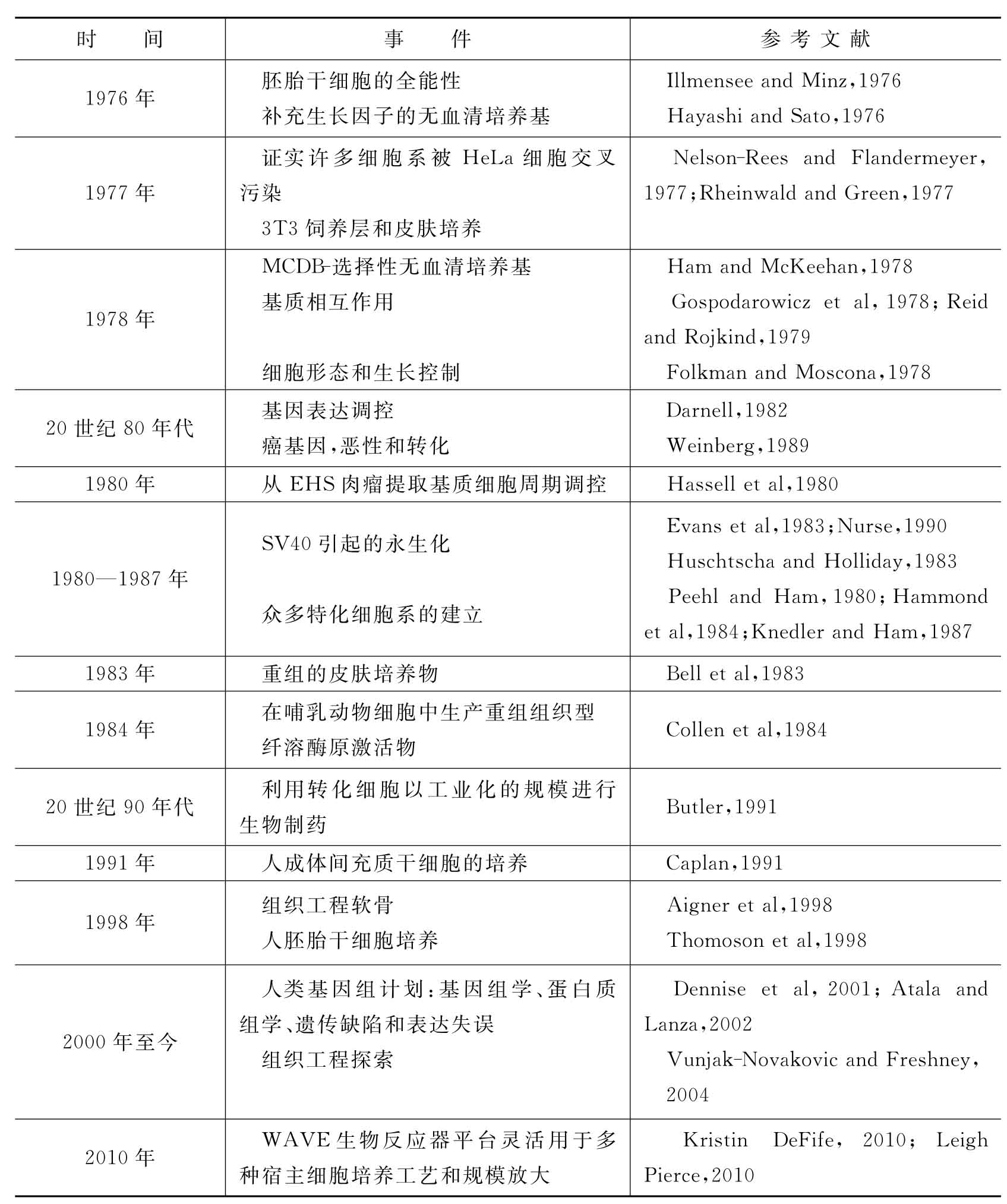
细胞培养和组织培养发展史中的关键事件见表1-1。
表1-1 细胞培养和组织培养发展史中的关键事件
续表

续表
三、动物细胞培养的优点和缺点
细胞培养是一种方法和技术,也是一门实验科学,在现代医学和生物科学研究中应用极为广泛,这与其一系列的优点是分不开的,具体包括以下几个方面。
(1)研究对象是活的离体细胞。根据要求可始终保持细胞的活力,并可长时间监控、检测,甚至定量评估一部分活细胞的情况,包括其形态、结构和生命活动等。
(2)研究内容便于观察、检测和记录。利用细胞培养技术研究细胞的生命活动规律,可以很方便地采用各种实验技术和方法来观察、检测和记录。例如,通过倒置相差显微镜等直接观察活的细胞;应用缩时电影技术、摄像或者通过闭路电视长时间连续记录和观察培养细胞的体外生长情况,可以直观揭示培养细胞的生命活动规律以及对所施加因素的反应;利用同位素标记、放射免疫等方法检测细胞内的物质合成和代谢变化等。
(3)研究条件可以人为地控制。进行体外细胞培养实验时,可以根据需要控制pH值、温度、O2浓度、CO2浓度等物理化学条件,并且可以做到相对的恒定。同时,可以施加化学、物理、生物等因素作为实验条件,这些因素同样可以处于严格控制之中。细胞培养技术使得在细胞存活的基础上独立研究细胞的生命活动、逐项研究细胞生存条件和细胞功能成为可能。
(4)样品的特征和均一性。细胞培养可同时提供大量均一性较好的细胞群,降低实验成本。取自一般组织的样本,其细胞类型多样,即使是来源于同一组织,也不可能做到均一性。但是体外培养一定代数的细胞,所得到的细胞系或细胞株则可达到细胞类型单一、细胞周期同步、生物学性状基本相同以及对实验因素反应一致等。这是因为每次传代时细胞随机混合,培养条件的选择性压力利于最有活力的细胞生长,进而产生性质较均一的培养物。需要时,还可采用克隆化等方法使细胞达到纯化。因此,细胞系的特征在经过几次传代后可能固定下来,如果储存于液氮中则该特性可永久保持。由于实验的复制样品基本上是相同的,因此不需要进行变异性的统计学分析。由于细胞培养可以提供大量均一性较好的实验样本,有时可比体内实验成本低得多。例如,一个需要100只鼠才能得出结论的实验可能只用100片盖玻片或几个多孔培养板就可获得具有相同统计学意义的结果。
(5)经济性、规模化和机械化。在进行体外培养对某种物质的筛选和重复性实验时,培养细胞可以受到低浓度、成分明确的试剂的直接作用,而体内注射时90%的试剂因排泄或并未分布到所研究的其他组织中而丢失,因此体外实验更经济,并且可避免动物实验存在的法律、道德和伦理问题。多孔培养板和自动化技术方面的新进展也使细胞培养更加经济有效,细胞培养已成为生物制品、单克隆抗体和基因工程制品等的生产手段。通过扩大细胞培养系统容量,可以大规模培养动物细胞以生产生物制品。目前,利用动物细胞大规模培养技术所生产的生物产品包括酶、单克隆抗体以及多种疫苗等生物制品或基因工程产品。
细胞培养的优点见表1-2。
表1-2 细胞培养的优点

续表

当然,细胞培养虽然具有以上一系列的优点,但也有以下几点不足之处。
(1)细胞培养环境与体内环境相比,仍有很大的差异。组织和细胞离体以后,独立生存在人工培养环境中,即使当前模拟体内技术发展很快,但与体内环境相比,仍有很大差异。因此在利用培养细胞做实验对象时,不应视为与体内细胞完全一样,轻易得出与体内等同的结论。
(2)体外培养的动物细胞对营养的要求比较高。动物细胞培养液中往往需要多种氨基酸、维生素、辅酶、核酸、嘌呤、嘧啶、激素和生长因子等,在很多情况下还需加入10%的胎牛血清或新生牛血清。
(3)动物细胞生长缓慢,对环境条件要求严格。动物细胞培养必须在严格的无菌条件下进行,因为动物细胞的生长比常见的污染微生物都要慢得多。此外,与微生物不同,正常状态下多细胞动物的细胞不能孤立存在,因而如果没有一个复杂的环境刺激和血浆或组织液的作用,它们将不能维持独立的存活状态。动物细胞培养不仅需要严格的防污染措施,同时还需用空气、氧、二氧化碳和氮的混合气体进行供氧和调节pH值。
(4)量的问题。细胞培养的一个主要局限性在于所付出的大量劳动和物质只能够生产相当少的一些组织。对于绝大多数小型实验室,每批的实际最大产量可能只有1~10g细胞,一个较大型的实验室,如稍作努力并在设备上多些投入,每批的产量则有可能达到10~100g,100g以上的产量则意味着达到了企业化的小规模生产水平,这是大多数实验室难以做到的。用培养的方式来生产细胞所需的投入要比直接用动物组织高出10倍,因此,当要采用培养的方法生产10g以上的组织时,就必须提供足以令人信服的理由。
(5)不稳定性是许多连续性细胞系所面临的主要问题。这是由它们的染色体组成不稳定所导致的。即便是未转化的细胞经过短期培养,细胞群体中生长速率和分化能力上的异质性也能导致细胞代与代之间的差异。
四、动物细胞培养技术的应用
现代生物技术包括基因工程、细胞工程、酶工程和发酵工程,这些技术的发展几乎都与细胞培养有密切的关系,特别是在生物和医药领域,细胞培养具有特殊的作用。比如基因工程药物或疫苗在研究和生产过程中很多是通过细胞培养来实现的,基因工程乙肝疫苗大多是以CHO细胞作为载体,基因工程抗体药物的制备也离不开细胞培养;细胞工程领域更离不开细胞培养技术,杂交瘤单克隆抗体的研究和制备完全是通过细胞培养来实现的;发酵工程和酶工程也与细胞培养密切相关。总之,细胞培养在整个生物技术产业的发展中起到了核心作用。
(1)动物细胞培养技术在生物学基础研究中的应用。
体外培养的动物细胞具有培养条件可人为控制且便于观察、检测的特点,因而可广泛应用于生物学领域的基础研究中。
①细胞生物学。动物细胞培养可用于研究动物的正常或病理细胞的形态、生长发育、营养、代谢以及病变等微观过程。
②遗传学研究。除可用培养的动物细胞进行染色体分析外,还可结合细胞融合技术建立细胞遗传学,进行遗传分析和杂交育种。
③病毒学研究。细胞培养为病毒的增殖提供了场所,细胞是分离病毒最好的和最方便的基质,利用细胞培养可准确进行病毒定性和定量的研究。另外,用细胞进行病毒增殖也是制备减毒活疫苗和诊断用抗原的一种主要方法。用培养的动物细胞代替实验动物做斑点分析,不仅方法简便、准确,而且重复性好。
(2)动物细胞培养技术在临床医学上的应用。
①可用于疾病的诊断。目前,人们已经能够用羊膜穿刺技术获得脱落于羊水中的胎儿细胞,经培养后进行染色体分析或甲胎蛋白检测,可诊断出胎儿是否患有遗传性疾病或先天畸形,以此可避免先天残疾儿的诞生。现在用这种方法已能检测出几十种代谢性遗传缺陷疾病和先天畸形疾病。我国的科学工作者改进了淋巴细胞的培养方法,从而使癌基因携带者的染色体表现出明显高于常人的畸变率,这就从细胞分子水平揭示了癌症的病理、病因,并为癌症的早期诊断和预防提供了科学依据。
②可用于临床治疗。目前已有将正常骨髓细胞经大量培养后植入造血障碍症患者体内进行治疗的报道。另外,利用动物细胞培养技术生产的生物大分子制品也可用于治疗某些代谢缺陷疾病,如利用动物细胞培养技术生产的重组人促红细胞生成素(rHuEPO)在临床上可用于治疗肾衰性贫血、癌症患者化疗后贫血,并对择期手术者的自身输血血液储备有极显著的效果。
③可用于新药筛选和药物效应的检测。例如,可用于化学合成药物药效研究、中药有效成分筛选与鉴定等。采用体外培养的动物细胞测试药物效应,不仅比用动物做实验经济,而且药物能直接与细胞接触,获得的实验结果更迅速、直观。同时,检测具有组织特异性的药物时,可选用相应的细胞,如检测抗癌药物可选用癌细胞,检测治疗肝病的药物可选用肝细胞。
(3)动物细胞培养技术在动物育种上的应用。
在胚胎工程中,体外培养卵母细胞并进行体外受精、胚胎分割和移植已发展成为一种较成熟的技术而应用于家畜的繁殖生产中。另外,分离和培养具有多潜能性的胚胎干细胞,还可用于动物克隆、细胞诱导分化、动物育种的研究,并可作为基因转移的高效表达载体。胚胎干细胞的研究成果和克隆羊“多利”的问世已为动物遗传育种开辟了一条新途径。
(4)动物细胞培养技术在大分子生物制品生产上的应用。
利用动物细胞大规模培养技术生产大分子生物制品始于20世纪60年代,当时是为了满足生产FMD(foot-and-mouth disease,口蹄疫)疫苗的需要。后来随着大规模培养技术的逐渐成熟和转基因技术的发展与应用,人们发现利用动物细胞大规模培养技术来生产大分子药用蛋白比利用原核细胞表达系统更有优越性。
①疫苗的生产。例如,病毒性疫苗(肝炎病毒疫苗、艾滋病疫苗等)、肿瘤疫苗(多肽疫苗)等的生产。用Vero细胞高密度培养工业化生产疫苗,用鸡胚细胞生产鸡法氏囊病、新城疫、马立克氏病等多种疫苗。
②基因工程药物的生产。例如,在临床医学中具有治疗价值的一些细胞生长因子(如干扰素、粒细胞生长因子、胸腺肽等)的生产。用转基因技术克隆hEPO基因,并在GHO-DHFR细胞中表达,生产重组人促红细胞生成素等。
③诊断用和药用单克隆抗体的生产。包括诊断用单克隆抗体、治疗用单克隆抗体的生产。
④细胞工程药物的生产。包括生物细胞内的一些生物活性多肽和生物活性物质(如人参皂甙、紫杉醇等)的生产。
目前,可用动物细胞生产的生物制品有各类疫苗、干扰素、激素、酶、生长因子、病毒杀虫剂、单克隆抗体等,其销售收入已占到世界生物技术产品的一半以上。随着动物细胞培养技术的发展,以后还会有更多的生物制品被开发,并造福于人类。
突破性技术:高通量培养细胞
细胞培养已经成为一种在生命科学领域的基础研究和临床应用研究中被广泛应用的实验技术,从药物研发到疫苗研制,再到基因功能的分析,都离不开细胞培养。细胞培养基本上是一项繁重的、大多需要手动的操作技术,但是近期Fraunhofer制造技术与自动化研究所联合马普协会分子细胞生物学研究所等研发了一个可完全自动培养细胞的系统。这台仪器(图1-4)的出现意味着细胞培养全自动时代的到来。

图1-4 全自动培养细胞系统
知识拓展
思考题
1.动物细胞培养技术现已应用到哪些领域?请举例说明。
2.什么是细胞培养?它与组织培养有何区别和联系?
3.细胞培养技术有何优点和缺点?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















